cho 1,3g kẽm tác dụng với HCl 7,3%. Phản ứng xong lấy lá kẽm ra khỏi dung dịch, rửa sạch làm khô thấy khối lượng lá kẽm giảm 0,65g so với trước phản ứng a) Tính thể tích khí H2 sinh ra ở điều kiện bình thường b) Tính khối lượng axit HCl đã tham gia phản ứng c) Tính nồng độ phần trăm của dung dịch sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


mAgNO3=5,1g
=> nAgNO3=0,03mol
PTHH: Zn+ 2AgNO3=>Zn(NO3)2+2Ag
0,06 <-0,03 ->0,03 ->0,06
mZn đã dùng:m=0,06.65=3,9g

Gọi \(n_{Zn\left(pư\right)}=a\left(mol\right)\)
PTHH: Zn + CuCl2 ---> Cu + ZnCl2
a a a
mgiảm = mZn (tan ra) - mCu (bám vào) = 65a - 64a = 0,0075
=> a = 0,0075 (mol)
=> mZn (pư) = 0,0075.65 = 0,4875 (g)
\(C_{MCuCl_2}=\dfrac{0,0075}{0,02}=0,375M\)
C% thì thiếu dCuCl2 nha
Gợi ý: \(C\%=C_M.\dfrac{M}{10.D}\left(D:\dfrac{g}{cm^3}hay\dfrac{g}{ml}\right)\)
Gọi \(n_{Zn}=x\left(mol\right)\Rightarrow n_{Cu}=x\left(mol\right)\)
Khối lượng giảm 0,0075g.
\(\Rightarrow m_{Zn}-m_{Cu}=0,0075\Rightarrow65x-64x=0,0075g\)
\(\Rightarrow x=0,0075\)
\(Zn+CuCl_2\underrightarrow{t^o}ZnCl_2+Cu\)
0,0075 0,0075
\(m_{Zn}=0,0075\cdot65=0,4875g\)
\(C_{M_{CuCl_2}}=\dfrac{0,0075}{0,02}=0,375M\)

Đáp án C
Zn + Fe2+ → Zn2+ + Fe
Mol x → x
=> Dmgiảm = mZn pứ - mFe tạo ra
=> 8,5 – 7,6 = 65x – 56x => x = 0,1 mol
=> mZn pứ = 65.0,1 = 6,5g

Theo gt ta có: $n_{Zn}=0,1(mol)$
a, $Zn+2HCl\rightarrow ZnCl_2+H_2$
b, Ta có: $n_{H_2}=0,1(mol)\Rightarrow V_{H_2}=2.24(l)$
c, Ta có: $n_{HCl}=2.n_{Zn}=0,2(mol)\Rightarrow m_{HCl}=7,3(g)$

a) Zn + 2HCl →ZnCl2 + H2
b) nZn = 6,5/65 = 0,1 mol . Theo tỉ lệ pư => nH2 = nZn = nZnCl2 =0,1 mol <=> VH2(đktc) = 0,1.22,4 = 2,24 lít.
c) mZnCl2 = 0,1 . 136 = 13,6 gam
d) nHCl =2nZn = 0,2 mol => mHCl = 0,2.36,5= 7,3 gam
Cách 2: áp dụng định luật BTKL => mHCl = mZnCl2 + mH2 - mZn
<=> mHCl = 13,6 + 0,1.2 - 6,5 = 7,3 gam

Gọi số mol Zn bị hòa tan là a (mol)
PTHH: Zn + FeSO4 --> ZnSO4 + Fe
______a---------------------------->a
=> 50 - 65a + 56a = 49,82
=> a = 0,02 (Mol)
=> mZn = 0,02.65 = 1,3(g)
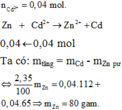
\(n_{Zn\left(pứ\right)}=1,3-0,65=0,65g\)
\(n_{Zn}=\dfrac{0,65}{65}=0,01mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,01 0,02 0,01 0,01 ( mol )
\(V_{H_2}=0,01.24=0,24l\)
\(m_{HCl}=\dfrac{0,02.36,5}{7,3\%}=10g\)
\(m_{ZnCl_2}=0,01.136=1,36g\)
\(m_{ddspứ}=1,3+10-0,01.2=11,28g\)
\(C\%_{ZnCl_2}=\dfrac{1,36}{11,28}.100=12,05\%\)