Hỗn hợp X gồm Na và Na2O . Hòa tan hết 1,31 gam hỗn hợp X vào 18,72 gam nước thu được dung dịch y và 0,336 lít H2( đktc ) a. Tính phần trăm của các chất trong hỗn hợp X b.Tính nồng độ % và nồng độ mol/l của các chất tan trong dung dịch Y . Biết khối lượng riêng của dung dịch Y bằng 1,2 g/ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Định hướng tư duy giải
Ta có:
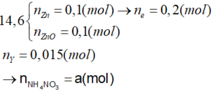
Có NH4NO3 vì nếu Y là N2
→ n e Max = 0 , 15 < 0 , 2 .
Sau khi cho KOH vào thì K nó chạy đi đâu? Việc trả lời CÂU hỏi này sẽ giúp ta tiết kiệm rất nhiều thời gian và không cần quan tâm HNO3 thừa thiếu thế nào.
0,74 mol KOH + X
→ BTNT . K n K N O 3 = 0 , 74 - 0 , 14 . 2 = 0 , 46 m o l n K 2 Z n O 2 = 0 , 2 - 0 , 06 = 0 , 14 m o l
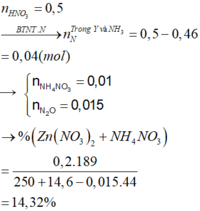

Ta có nZn = nZnO = 0,1 mol, nHNO3 = 0,5 mol
Kết tủa thu được là Zn(OH)2: 0,06 mol
Vậy dung dịch sau phản ứng + KOH chứa K2ZnO2: (0,1 + 0,1 - 0,06) = 0,14 mol và KNO3: (0,74 - 2 × 0,14) = 0,46 mol
Bảo toàn nguyên tố N → nN (Y) + nNH4 + = 0,5 - 0,46 = 0,04 mol
Nếu khí Y chứa 1 nguyên tố N (NO và NO2) → nNH4+ = 0,04 - 0,015 = 0,025
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,025×80,015 = 0 (Vô lý)
Vậy khí Y chứa 2 nguyên tố N (N2, N2O) → nNH4+ = 0,04 - 0,015 × 2 = 0,01 mol
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,01×80,015 = 8 → khí tạo thành là N2O
Bảo toàn khối lượng → mdd = 14,6 + 250 - 0,015 × 44 = 263,94 gam
C% Zn(NO3)2 = (0,2×189/ 263,94 )×100% = 14,32%
Đáp án C

Chọn đáp án D
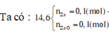


Có NH4NO3 vì nếu Y là N2 ![]()
Sau khi cho KOH vào thì K nó chạy đi đâu?Việc trả lời câu hỏi này sẽ giúp ta tiết kiệm rất nhiều thời gian và không cần quan tâm HNO3 thừa thiếu thế nào.
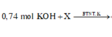

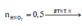
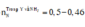
![]()
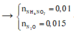
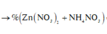
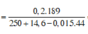
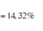

a)
$2K + 2H_2O \to 2KOH + H_2$
$BaO + H_2O \to Ba(OH)_2$
Theo PTHH :
$n_K = 2n_{H_2} = 0,2(mol)$
$\%m_K = \dfrac{0,2.39}{23,1}.100\% = 33,77\%$
$\%m_{BaO} = 100\%- 33,77\% = 66,23\%$
b)
$n_{BaO} = \dfrac{23,1 - 0,2.39}{153} = 0,1(mol)$
$m_{dd} = 23,1 + 177,1 - 0,1.2 = 200(gam)$
$C\%_{KOH} = \dfrac{0,2.56}{200}.100\% = 5,6\%$
$C\%_{Ba(OH)_2} = \dfrac{0,1.171}{200}.100\% = 8,55\%$
c)
$KOH + HCl \to KCl + H_2O$
$Ba(OH)_2 + 2HCl \to BaCl_2 + 2H_2O$
$n_{HCl} = 2n_{Ba(OH)_2} + n_{KOH} = 0,4(mol)$
$V = \dfrac{0,4}{0,5} = 0,8(lít) = 800(ml)$

Qui đổi hỗn hợp về x mol Na ; y mol Ba và z mol
O, ta có: Na + H2O → NaOH + 0,5H2
Ca + H2O → Ca(OH)2 + H2
O + H2 → H2O
=> mX = 23x + 40y + 16z = 5,13 g nH2 = 0,5x + y –z = 0,025 mol
n NaOH = n Na = x = 0,07 mol
=>y=0,06 mol ; z=0,07 mol
=>n OH- = n NaOH + 2 nCa(OH)2 = 0,19 mol
=> Có n OH >2 n SO2
=> tạo muối trung hòa, OH dư
=>m CaSO3 = 0,06.120 = 7,2 g
=>C

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ n_{Al}=x(mol);n_{Mg}=y(mol)\\ \Rightarrow 27x+24y=7,8(1)\\ a,2Al+6HCl\to 2AlCl_3+3H_2\\ Mg+2HCl\to MgCl_2+H_2\\ \Rightarrow 1,5x+y=0,4(2)\\ (1)(2)\Rightarrow x=0,2(mol);y=0,1(mol)\\ \Rightarrow \%_{Al}=\dfrac{0,2.27}{7,8}.100\%=69,23\%\\ \Rightarrow \%_{Mg}=100\%-69,23\%=30,77\%\)
\(b,\Sigma n_{HCl}=3x+2y=0,8(mol)\\ \Rightarrow C\%_{HCl}=\dfrac{0,8.36,5}{192,2}.100\%=15,19\%\\ c,n_{AlCl_3}=0,2(mol);n_{MgCl_2}=0,1(mol)\\ \Rightarrow C\%_{AlCl_3}=\dfrac{0,2.133,5}{0,2.27+192,2-0,3.2}.100\%=13,55\%\\ C\%_{MgCl_2}=\dfrac{0,1.95}{0,1.24+192,2-0,1.2}.100\%=4,89\%\)

Chọn B.
n(KOH) = 0,4 mol ; n(H2) 0,15 mol
Quy đổi hh X về: K (0,4 mol); Na (x mol); O ( y mol).
Ta có hệ:
23x + 16y + 0,4.39 = 25,7
x + 0,4 = 0,15.2 + 2.y ( bảo toàn e).
Giải hệ: x = 0,3; y = 0,3
Dung dịch Y chứa: KOH (0,4 mol) và NaOH ( 0,3 mol).
→ n(OH-) = 0,7 mol.
Xét n(OH-)/n(H3PO4) = 0,7 : 0,4 = 1,75 nên tạo 2 muối H2PO4- ( a mol) và HPO42- ( b mol)
Có hệ:
a + 2b = 0,7 ( bảo toàn điện tích)
a + b = 0,4 ( bảo toàn nguyên tố P)
Giải hệ: a = 0,1; b = 0,3.
Nên muối gồm: 0,1 mol H2PO43-; 0,3 mol HPO42-; 0,3 mol Na+; 0,4 mol K+.
→ m(muối) = 61 gam.

a)
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,03<------------0,03<----0,015
=> \(\%m_{Na}=\dfrac{0,03.23}{1,31}.100\%=52,67\%\)
=> \(\%m_{Na_2O}=100\%-52,67\%=47,33\%\)
b)
\(n_{Na_2O}=\dfrac{1,31.47,33\%}{62}=0,01\left(mol\right)\)
PTHH: Na2O + H2O --> 2NaOH
0,01----------->0,02
=> nNaOH = 0,03 + 0,02 = 0,05 (mol)
mdd sau pư = 1,31 + 18,72 - 0,015.2 = 20 (g)
=> \(C\%_{dd.NaOH}=\dfrac{0,05.40}{20}.100\%=10\%\)
\(V_{dd.NaOH}=\dfrac{20}{1,2}=\dfrac{50}{3}\left(ml\right)=\dfrac{1}{60}\left(l\right)\)
\(C_{M\left(dd.NaOH\right)}=\dfrac{0,05}{\dfrac{1}{60}}=3M\)