Bài 9: Đốt cháy hoàn toàn 6,2 gam phosphorus (P) trong không khí, thu được m (g) chất rắn A, hòa tan chất rắn A vào nước tạo ra dung dịch B.
a) Tính m (gam) chất rắn A.
b) Dung dịch B có làm quì tím đổi màu không? Màu gì? Vì sao?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,1--------------->0,05
=> mP2O5 = 0,05.142 = 7,1 (g)
b)
PTHH: P2O5 + 3H2O --> 2H3PO4
dd B là dd axit nên quỳ tím chuyển màu đỏ

$CaCO_3 \xrightarrow{t^o} CaO +C O_2$
Theo PTHH : $n_{CaO} = n_{CO_2} = n_{CaCO_3} = 0,15(mol)$
$a = 0,15.56 = 8,4(gam)$
$V = 0,15.22,4 = 3,36(lít)$
$CaO + H_2O \to Ca(OH)_2$
$m_{dd\ X} = a + m_{H_2O} = 8,4 + 191,6 = 200(gam)$
$C\%_{Ca(OH)_2} = \dfrac{0,15.74}{200}.100\% = 5,55\%$
Dung dịch X làm quỳ tím hóa xanh

Đáp án D
► Đặt CT chung của A là CnH2n+2O (n ≥ 1), B và C là CmH2mO2 (m > 1).
⇒ Phương trình cháy:
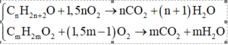
⇒ ∑nB,C = 1,5.∑nCO2 – ∑nO2 = 0,03 mol ⇒ Q gồm 0,03 mol muối và 0,02 mol NaOH dư.
► nNaOH = 0,02 + 0,005 = 0,025 mol || RCOONa + NaOH → t o C a O RH + Na2CO3.
⇒ muối dư, NaOH. Thêm 0,005 mol NaOH ⇄ 0,2 gam NaOH vào để đủ. Bảo toàn khối lượng:
⇒ m = (3,26 + 0,2 + 0,2 – 0,03 × 106) × 0,025 ÷ 0,03 = 0,4(g)

Đáp án D
► Đặt CT chung của A là CnH2n+2O (n ≥ 1), B và C là CmH2mO2 (m > 1).
⇒ Phương trình cháy: 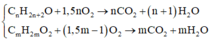
⇒ ∑nB,C = 1,5.∑nCO2 – ∑nO2 = 0,03 mol ⇒ Q gồm 0,03 mol muối và 0,02 mol NaOH dư.
► nNaOH = 0,02 + 0,005 = 0,025 mol || RCOONa + NaOH → CaO , t ° RH + Na2CO3.
⇒ muối dư, NaOH. Thêm 0,005 mol NaOH ⇄ 0,2 gam NaOH vào để đủ. Bảo toàn khối lượng:
⇒ m = (3,26 + 0,2 + 0,2 – 0,03 × 106) × 0,025 ÷ 0,03 = 0,4(g)
Bài 9:
a) \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,2->0,25------> 0,1
=> mP2O5 = 0,1.142 = 14,2 (g)
b)
P2O5 + 3H2O --> 2H3PO4
dd H3PO4 là dd axit nên quỳ tím đổi màu đỏ