Cho a gam hỗn hợp gồm Zn và Al vào dung dịch axit clohiđric (HCl) dư. Sau phản ứng thu được 3,36 lít H2 ở đktc. Tính a?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol của Ba, Al và Mg lần lượt là x, y và z mol
Lượng khí thu được khi cho A vào nước dư ít hơn khi cho A vào xút dư nên khi cho A vào nước dư thì Ba phản ứng hết, Al phản ứng một phần. Khi cho A vào xút dư thì cả Ba và Al đều phản ứng hết.
Cho A tác dụng với nước dư có phản ứng:
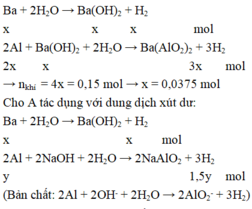

Khối lượng của A là: m = 0,0375.137 + 0,175.27 + 0,1.24 = 12,2625 gam.
⇒ Chọn B

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}n_{HCl}=\dfrac{12,7}{36,5}=\dfrac{127}{365}\left(mol\right)\\n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\end{matrix}\right.\)
Ta thấy: \(2n_{H_2}< n_{HCl}\) \(\Rightarrow\) Axit còn dư
b) Theo PTHH: \(n_{HCl\left(p/ứ\right)}=2n_{H_2}=0,3\left(mol\right)\) \(\Rightarrow m_{HCl}=0,3\cdot36,5=10,95\left(g\right)\)
Mặt khác: \(m_{H_2}=0,15\cdot2=0,3\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl\left(p/ứ\right)}-m_{H_2}=18,65\left(g\right)\)
c) PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Khi 8 gam kim loại p/ứ với HCl dư tạo 0,15 mol H2
\(\Rightarrow\) 8 gam kim loại p/ứ với H2SO4 dư cũng tạo 0,15 mol H2
\(\Rightarrow n_{H_2}=n_{H_2SO_4\left(p/ứ\right)}=0,15\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(p/ứ\right)}=0,15\cdot98=14,7\left(g\right)\)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ 2K+2H_2O\rightarrow2KOH+H_2\\ 2Na+2H_2O\rightarrow2NaOH+H_2\\ KOH+HCl\rightarrow KCl+H_2O\\ NaOH+HCl\rightarrow NaCl+H_2O\\ n_{HCl}=n_{KOH}+n_{NaOH}=2.n_{H_2}=2.0,15=0,3\left(mol\right)\\ m_{HCl}=0,3.36,5=10,95\left(g\right)\)

Chọn đáp án B
Vì glyxin có 1 nhóm –COOH ⇒ nGlyxin = nNaOH = 0,1 mol.
⇒ VNaOH = 0,1 ÷ 1 = 0,1 lít = 100 ml ⇒ Chọn B

Chọn đáp án D
Nhận thấy chỉ có Al tác dụng được với HCl.
+ Bảo toàn e ⇒ nAl = 2 × nH2 ÷ 3 = 0,1 mol ⇒ mAl = 2,7 gam
⇒ %mAl/hỗn hợp = 2 , 7 5 × 100 = 54% ⇒ Chọn D

Chọn đáp án A.
n H 2 = 3 , 36 22 , 4 = 0 , 15 m o l
![]()
n A l = 2 3 n H 2 = 0 , 1 m o l
→ m A l = 0 , 1 . 27 = 2 , 7 g a m
% m A l = 2 , 7 5 . 100 % = 54 %

\(n_{H_2}=\dfrac{3.36}{22.4}=0,15\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2 ( 1)
0,15 0,15
PTHH : 2Al + 6HCl -> 2AlCl3 + 3H2 ( 2 )
0,1 0,15
\(m_{Zn}=0,15.65=9,75\left(g\right)\)
\(m_{Al}=27.0,1=2,7\left(g\right)\)
\(m_{hh}=9,75+2,7=12,45\left(g\right)\)
nH2=3,36:22,4=0,15(mol)
có PTHH:
Zn+2HCl--->ZnCl2+H2
0,15 0,15(mol)
2Al+6HCl--->2AlCl3+3H2
0,1 0,15(mol)
mAl=0,1x27=2,7(g)
mZn=0,15x65=9,75(g)
ma=2,7+9,75=12,45(g)