Nung 18,4 gam hỗn hợp CaCO3 và MgCO3. Phản ứng xong, người ta thu được hỗn hợp chất rắn có khối lượng giảm 8,8 gam so với hỗn hợp trước khi nung.
a. Viết các PTPU đã xảy ra.
b. Vì sao khối lượng sau phản ứng lại giảm?
c. Tính khối lượng mỗi chất có trong hỗn hợp trước khi nung.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
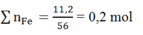
Khi ngâm m gam vào dung dịch Cu(NO3)2 thì chỉ có Fe phản ứng:
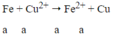
Δm = 64a - 56a = 8a → nFe = 0,4/8 = 0,05 mol
Fe3O4 → 3Fe
b 3b
Ta có: 0,05 + 2b = 0,2 → b = 0,05 mol
m = 0,05.56 + 0,05.232 = 14,4g

Đáp án D
Khối lượng Fe = 0,3m gam và khối lượng Cu = 0,7m gam
Sau phản ứng còn 0,75m gam → Fe chỉ phản ứng 0,25m gam; Fe dư vậy sau phản ứng chỉ thu được muối Fe2+.
Ta có:
![]()
Số mol của Fe(NO3)2 = 0,25m/56
Sơ đồ phản ứng:
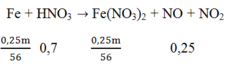
Áp dụng ĐLBT nguyên tố N ta có:
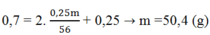

Chọn A.
Ta có: n Y = n H 2 = 0 , 04 m o l mol
=> E gồm các este của ancol (0,04) và các este của phenol (0,08 – 0,04 = 0,04)
mà n H 2 O = n este của phenol = 0,04 mol và n K O H = n este của ancol + 2neste của phenol = 0,12 mol
→ B T K L m E + m K O H = m muối + m ancol + m H 2 O Þ m muối = 13,7 gam






a)
MgCO3 --to--> MgO + CO2
CaCO3 --to--> CaO + CO2
b) Khối lượng rắn sau pư giảm do có khí CO2 thoát ra
c) \(m_{giảm}=m_{CO_2}=8,8\left(g\right)\)
=> \(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\)
Gọi số mol CaCO3, MgCO3 là a, b (mol)
=> \(\left\{{}\begin{matrix}a+b=0,2\\100a+84b=18,4\end{matrix}\right.\)
=> a = 0,1 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}m_{CaCO_3}=0,1.100=10\left(g\right)\\m_{MgCO_3}=0,1.84=8,4\left(g\right)\end{matrix}\right.\)