Lưu huỳnh cháy trong không khí theo phương trình phản ứng
S+O2->SO2
Biết khối lượng lưu huỳnh tham gia phản ứng là 3,2g
a.Tính thể tích khí SO2 sinh ra ở đktc
b.Tính thể tích không khí cần dùng ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Phương trình hóa học S + O2 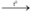 SO2
SO2
b) nS = 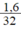 = 0,05 mol.
= 0,05 mol.
Theo phương trình trên, ta có:
nSO2 = nS = nO2 = 0,05 mol.
⇒ VSO2 = 0,05 .22,4 = 1,12 l.
⇒ VO2 = 22,4.0,05 = 1,12 l
Vì khí oxi chiếm 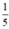 thể tích của không khí nên thể tích không khí cần là
thể tích của không khí nên thể tích không khí cần là
⇒ Vkk = 5VO2 = 5.1,12 = 5,6 l

a) Phương trình hóa học của S cháy trong không khí:
S + O2 → SO2
b. Số mol của S tham gia phản ứng:
nS = = 0,05 mol
Theo phương trình hóa học, ta có: = nS =
= 0,05 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là:
= 22,4 . 0,05 = 1,12 lít
Tương tự thể tích khí oxi cần dùng ở đktc là:
= 22,4 . 0,05 = 1,12 lít
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
=> Vkk = 5 = 5 . 1,12 = 5,6 lít

a) \(PTHH:S+O_2\) → \(SO_2\)
b) \(n_S=\dfrac{m}{M}=\dfrac{1,6}{32}=0,05\left(mol\right)\)
Theo PTHH
⇒ \(n_S=n_{O_2}=n_{SO_2}=0,05\left(mol\right)\)
\(V_{O_2\left(đktc\right)}=n.22,4=0,05.22,4=1,12\left(l\right)\)
Vì khí O2 chiếm 1/5 thể tích của không khí
⇒ \(V_{kk\left(đktc\right)}=5.1,12=5,6\left(l\right)\)

a) $S + O_2 \xrightarrow{t^o} SO_2$
b)
Theo PTHH :
$n_{O_2} = n_{SO_2} = n_S = \dfrac{3,2}{32} = 0,1(mol)$
$m_{O_2} = 0,1.32 = 3,2(gam)$
$V_{SO_2} = 0,1.22,4 = 2,24(lít)$
Ta có: n S = 3,2 / 32 = 0,1 ( mol )
PTHH: S + O2 \(\rightarrow\) SO2
0,1--0,1-----0,1
Theo pthh
n O2 = 0,1 ( mol ) => m O2 = 3,2 ( g )
n SO2 = 0,1 ( mol ) => V SO2 = 2,24 ( lít )

\(n_{O_2}=\dfrac{4}{32}=0,125\left(mol\right)\\ S+O_2\rightarrow\left(t^o\right)SO_2\\ n_{SO_2}=n_{O_2}=0,125\left(mol\right)\\ \Rightarrow V_{SO_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)

b1:
PTHH: \(S+O_2\Rightarrow SO_2\)
b2:
nSO2=\(\dfrac{m}{M}=\dfrac{4}{64}=0,0625mol\)
b4:
VSO2=22,4.n=22,4.0,0625=1,4 (lít)

\(n_S=\dfrac{3.2}{32}=0.1\left(mol\right)\)
\(n_{O_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.05.0.05...0.05\)
\(\Rightarrow Sdư\)
\(V_{SO_2}=0.05\cdot22.4=1.12\left(l\right)\)
\(b.\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.1..0.1\)
\(V_{kk}=5V_{O_2}=5\cdot0.1\cdot22.4=11.2\left(l\right)\)

a, PT: \(S+O_2\underrightarrow{t^o}SO_2\)
Ta có: \(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\), ta được S dư.
Theo PT: \(n_{SO_2}=n_{O_2}=0,05\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,05.22,4=1,12\left(l\right)\)
b, Theo PT: \(n_{O_2}=n_S=0,1\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
\(\Rightarrow V_{kk}=2,24.5=11,2\left(l\right)\)
\(n_S=\dfrac{3,2}{32}=0,1mol\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
0,1 0,1 0,1 ( mol )
\(V_{SO_2}=0,1.22,4=2,24l\)
\(V_{kk}=V_{O_2}.5=\left(0,1.22,4\right).5=11,2l\)
a. \(n_S=\dfrac{3.2}{32}=0,1\left(mol\right)\)
PTHH : S + O2 ---to---> SO2
0,1 0,1 0,1
\(V_{SO_2}=0,1.22,4=2,24\left(l\right)\)
b. \(V_{O_2}=0,1.22,4=2,24\left(l\right)\\V_{kk}=2,24.5=11,2\left(l\right) \)