Đốt cháy hoàn toàn v lít hỗn hợp khí CH4 và H2 có tỉ khối đối với Hidro là 4,5 cần dùng 56 l khí không khí biết thể tích không khí gấp 5 lần thể tích Oxi và có thể tích đo được ở điều kiện tiêu chuẩn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
\(a,PTHH:C_2H_4+5O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(n_{C_2H_4}=\dfrac{V_{\left(đktc\right)}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(Theo.PTHH:n_{O_2}=5.n_{C_2H_4}=5.0,25=1,25\left(mol\right)\\ V_{O_2\left(đktc\right)}=n.22,4=1,25.22,4=28\left(l\right)\)
\(b,\Rightarrow V_{kk\left(đktc\right)}=5.V_{O_2\left(đktc\right)}=5.28=140\left(l\right)\)
B1:
\(C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
Vì số mol tỉ lệ thuận với thể tích, đồng thời nhìn PTHH, ta sẽ được:
\(a,V_{O_2\left(đktc\right)}=3.V_{C_2H_4\left(đktc\right)}=3.5,6=16,8\left(l\right)\)
\(b,V_{kk}=5.V_{O_2\left(đktc\right)}=16,8.5=84\left(l\right)\)
B2:
Đặt số mol metan, etylen lần lượt là a,b (mol) (a,b>0)
\(n_{hh}=n_{CH_4}+n_{C_2H_4}=a+b=\dfrac{3,36}{22,4}=0,15\left(1\right)\)
PTHH: CH4 +2 O2 -to-> CO2 +2 H2O
C2H4 +3 O2 -to-> 2CO2 + 2H2O
\(n_{CO_2\left(tổng\right)}=a+2b=\dfrac{8,8}{44}=0,2\left(mol\right)\left(2\right)\)
(1), (2) =>a=0,1; b=0,05
Số mol tỉ lệ tương ứng với thể tích. Nên:
\(\%V_{CH_4}=\%n_{CH_4}=\dfrac{0,1}{0,15}.100\approx66,667\%\\ \Rightarrow\%V_{C_2H_4}\approx33,333\%\)

nCH4 = 4,48/22,4 = 0,2 (mol)
PTHH: CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: 0,2 ---> 0,4 ---> 0,2 ---> 0,4
Vkk = 0,2 . 5 . 22,4 = 44,8 (l)
mCO2 = 0,2 . 44 = 8,8 (g)
mH2O = 0,4 . 18 = 7,2 (g)
PTHH: Ca(OH)2 + CO2 -> CaCO3 + H2O
Mol: 0,2 <--- 0,2 ---> 0,2
mCaCO3 = 0,2 . 100 = 20 (g)

\(n_{C_2H_4}=\dfrac{13,44}{22,4}=0,6mol\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
0,6 1,8 1,2 1,2
a)\(V_{O_2}=1,8\cdot22,4=40,32l\)
\(V_{kk}=5V_{O_2}=5\cdot40,32=201,6l\)
b)\(m_{CO_2}=1,2\cdot44=52,8g\)
\(m_{H_2O}=1,2\cdot18=21,6g\)
c)\(n_{NaOH}=0,3\cdot2=0,6mol\)
\(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
1,2 0,6 0 0
0,3 0,6 0,3 0,3
0,9 0 0,3 0,3
\(m_{muối}=0,3\cdot106=31,8g\)
\(m_{H_2O}=0,3\cdot18=5,4g\)
nC2H4 = 13,44/22,4 = 0,6 (mol)
PTHH: C2H4 + 3O2 -> (t°) 2CO2 + 2H2O
Mol: 0,6 ---> 1,8 ---> 1,2 ---> 1,2
VO2 = 1,8 . 22,4 = 40,32 (l)
Vkk = 40,32 . 5 = 201,6 (l)
mCO2 = 1,2 . 44 = 52,8 (g)
mH2O = 1,2 . 18 = 21,6 (g)

a) CH4 + 2O2 \(\underrightarrow{t^o}\) CO2 + 2H2O.
C2H4 + 3O2 \(\underrightarrow{t^o}\) 2CO2 + 2H2O.
b) Gọi x là lượng CH4 ban đầu, lượng C2H4 ban đầu là 2x.
Ta có: x+2x=13,44/22,4 \(\Rightarrow\) x=0,2.
Thể tích khí CO2 sinh ra là \(V_{CO_2}\)=(0,2+0,2.2.2).22,4=22,4 (lít).

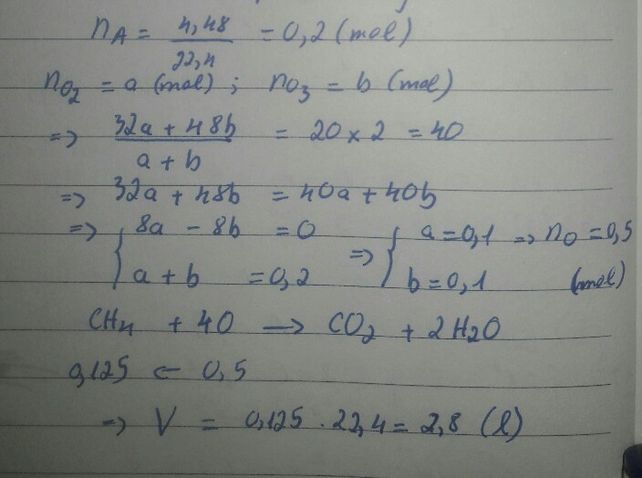

\(M_{hỗn\ hợp} = 4,5.2 = 9\\ Gọi : n_{CH_4} = a(mol) ; n_{H_2} = b(mol)\\ \Rightarrow 16a + 2b =9(a + b)\ (1) n_{O_2} = \dfrac{56}{5.22,4} = 0,5(mol)\\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ n_{O_2} = 2a + 0,5b = 0,5(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,2\\ \Rightarrow V = (0,2 + 0,2).22,4 = 8,96(lít)\)
Đề không hợp lí em ơi, CO2 và H2O đều không cháy được nhé.