Cho 10,8g nhôm vào dung dịch chứa 73g HCl. Hãy tính:
a) Khối lượng chất dư sau phản ứng.
b) Thể tích khí hidrô thoát ra ở đktc.
c) Cho lượng khí thoát ra ở trên tác dụng với 34,8g oxit sắt tạo thành sắt nguyên chất và nước. Xác định công thức oxit sắt đem dùng.

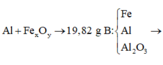
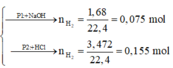
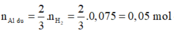
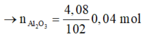
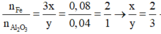


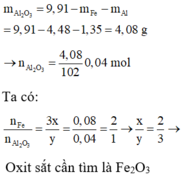
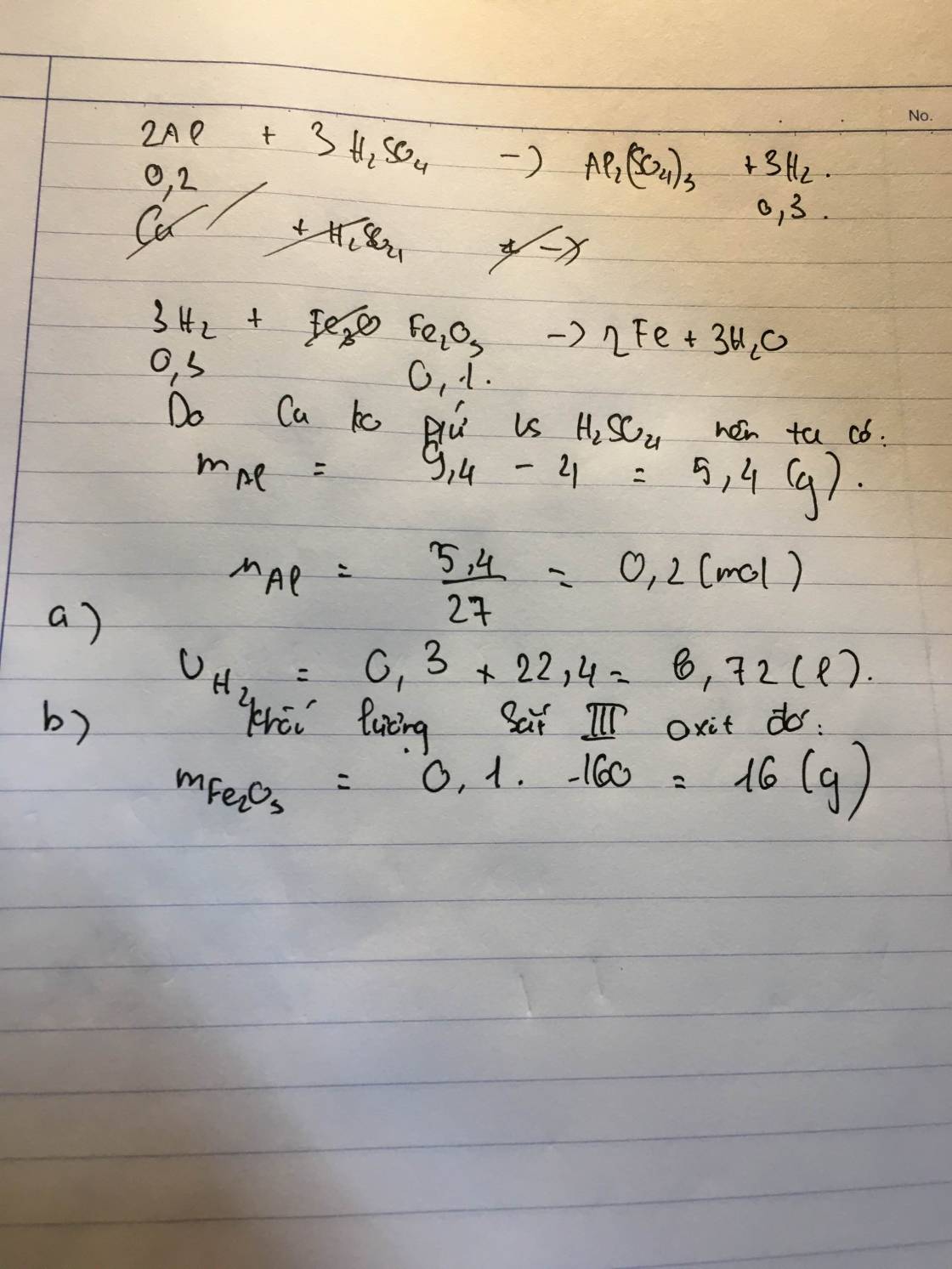
\(a) n_{Al} = \dfrac{10,8}{27} = 0,4(mol) ; n_{HCl} = \dfrac{73}{36,5} = 2(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ n_{HCl} = 2 > 3n_{Al} = 0,4.3 = 1,2 \to HCl\ dư\\ n_{HCl\ pư} = 3n_{Al} = 1,2(mol)\\ \Rightarrow m_{HCl\ dư} = (2 - 1,2).36,5 = 29,2(gam)\\ b) n_{H_2} = \dfrac{3}{2}n_{Al} = 0,6(mol)\Rightarrow V_{H_2} = 0,6.22,4 = 13,44(lít)\\ c) H_2 + O_{oxit} \to H_2O\\ n_O = n_{H_2} = 0,6(mol)\\ m_{oxit\ sắt} = m_{Fe} + m_O \Rightarrow n_{Fe}= \dfrac{34,8-0,6.16}{56} = 0,45(mol)\\ \)
\(\dfrac{n_{Fe}}{n_O} = \dfrac{0,45}{0,6} = \dfrac{3}{4}\\ Oxit : Fe_3O_4\)