Bài 1: Đốt 4,48 lít hidro ở đktc trong không khí.
a. Tính khối lượng nước thu được
b. Tính thể tích không khí cần dùng để đốt cháy hết lượng khí H2 ở trên. Coi oxi chiếm 20% thể tích không khí
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CO_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(C_2H_5OH+3O_2\underrightarrow{t^o}2CO_2+3H_2O\)
0,2 0,6 0,4 0,6
a)\(m_{C_2H_5OH}=0,2\cdot46=9,2g\)
b)\(V_{O_2}=0,6\cdot22,4=13,44l\)
\(\Rightarrow V_{kk}=5V_{O_2}=5\cdot13,44=67,2l\)

a. \(n_{Fe}=\dfrac{1,8.10^{23}}{6.10^{23}}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{6.72}{22,4}=0,3\left(mol\right)\)
PTHH : 3Fe + 2O2 -> Fe3O4
0,3 0,2 0,1
Ta thấy : \(\dfrac{0.3}{3}< \dfrac{0.3}{2}\) => Fe đủ , O2 dư
\(m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
b. \(V_{O_2}=0,2.22,4=4,48\left(l\right)\)
\(V_{kk}=4,48.5=22,4\left(l\right)\)
a)\(n_{Fe}=\dfrac{1,8\cdot10^{23}}{6\cdot10^{23}}=0,3mol\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,3 0,3 0
0,3 0,2 0,1
0 0,1 0,1
\(m_{Fe_3O_4}=0,1\cdot232=23,2g\)
b)\(V_{O_2}=0,1\cdot22,4=2,24l\)
\(\Rightarrow V_{kk}=5V_{O_2}=5\cdot2,24=11,2l\)

\(n_{CO_2}=\frac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH : \(C+O_2\underrightarrow{t^0}CO_2\)
PT : 1mol 1mol
Đề : 0,4mol ?mol
=> \(n_{O_2}=\frac{0,4\cdot1}{1}=0,4\left(mol\right)\)
=> \(V_{O_2}=0,4\cdot22,4=8,96\left(l\right)\)
\(V_{kk}\cdot20\%=V_{O_2}\Rightarrow V_{kk}=\frac{V_{O_2}}{20\%}=\frac{8,96}{20\%}=44,8\left(l\right)\)
=> \(V_{kk}=44,8l\)

Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
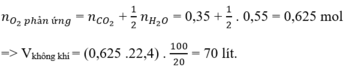

a)
\(m_{MgCl_2}=\dfrac{50.4}{100}=2\left(g\right)\Rightarrow m_{H_2O}=50-2=48\left(g\right)\)
b)
\(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,2->0,2
=> VO2 = 0,2.22,4 = 4,48 (l)
=> Vkk = 4,48 : 20% = 22,4 (l)
a.\(m_{MgCl_2}=\dfrac{50.4}{100}=2g\)
\(m_{H_2O}=50-2=48g\)
b.\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
0,2 0,2 ( mol )
\(V_{kk}=V_{O_2}.5=\left(0,2.22,4\right).5=22,4l\)
2H2+O2-to>2H2O
0,2----0,1-----0,2
n H2=0,2 mol
=>m H2O=0,2.18=3,6g
=>Vkk=0,1.22,4.5=11.2l
a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2H2 + O2 ----to----> 2H2O
Mol: 0,2 0,1 0,2
\(m_{H_2O}=0,2.18=3,6\left(g\right)\)
b, \(V_{O_2}=0,1.22,4=2,24\left(l\right)\Rightarrow V_{kk}=2,24.5=11,2\left(l\right)\)