Cho mẩu Na vào nước thấy có 4,48 lit khí H2 bay ra (đktc). Khối lượng Na đã phản ứng là bao nhiêu gam ?Trình đọc Chân thực (1 Điểm)
9,2 gam.
4,6 gam.
2,9 gam.
4 gam.
mn giúp em vs, em cảm ơn ạ (;´༎ຶД༎ຶ`) ༼;´༎ຶ ༎ຶ༽༼;´༎ຶ ༎ຶ༽
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\\ n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\\ LTL:\dfrac{0,2}{2}>\dfrac{0,1}{2}\\ \Rightarrow Nadư\\ n_{Na\left(pứ\right)}=n_{H_2O}=0,1\left(mol\right)\\ n_{Na\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\\ \Rightarrow m_{Na}=0,1.23=2,3\left(g\right)\\ n_{H_2}=\dfrac{1}{2}n_{H_2O}=0,05\left(mol\right)\\ \Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)

2Na+2H2o->2NaOH+H2
0,2------------------0,2----0,1
n NaOH=0,2 mol
=>m Na=0,2.23=4,6g
=>VH2=0,1.22,4=2,24l
\(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
PTHH: 2Na + 2H2O ---> 2NaOH + H2
0,2 0,2 0,1
\(\rightarrow\left\{{}\begin{matrix}m_{Na}=0,2.23=4,6\left(g\right)\\V_{H_2}=0,1.22,4=2,24\left(l\right)\end{matrix}\right.\)

HD:
Thí nghiệm 1 chỉ có Na phản ứng:
Na + HOH \(\rightarrow\) NaOH + 1/2H2 (1)
0,4 0,2 mol
Thí nghiệm 2 chỉ có Al phản ứng (kim loại lưỡng tính):
Al + OH- + H2O \(\rightarrow\) AlO2- + 3/2H2 (2)
0,7/3 0,35 mol
Thí nghiệm 3 cả 3 chất đều phản ứng:
2Na + H2SO4 \(\rightarrow\) Na2SO4 + H2 (3)
Mg + H2SO4 \(\rightarrow\) MgSO4 + H2 (4)
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 (5)
Gọi x, y, z tương ứng là số mol của Na, Mg và Al trong a gam hh.
Ta có: x = 0,4 mol; z = 0,7/3 mol; x/2 + y + 3z/2 = 0,5. Suy ra: y = -0.5 < 0 (vô lí)
Bạn xem lại đề bài, đề bài ko đúng.

Đáp án D
Quy hỗn hợp thành Na Ba và O
ta có sơ đồ:
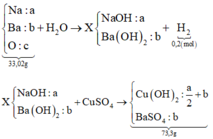
PT theo khối lượng hỗn hợp ban đầu:
23a + 137b + 16c = 33,02 (1)
PT theo bảo toàn e:
a + 2b – 2c = 2nH2 = 0,4 (2)
PT theo khối lượng kết tủa:
49a + 331b = 73,3 (3)
+ Giải hệ ta có
nNa = 0,28 và nBa = 0,18.
⇒ ∑nOH– = 0,28 + 0,18×2 = 0,64 mol.
+ Sục 0,45 mol CO2
⇒ nCO32– = 0,64 – 0,45 = 0,19 mol
Nhận thấy nCO32– > nBa2+
⇒ nBaCO3 = nBa2+ = 0,18 mol.
⇒ mKết tủa = mBaCO3
= 0,18×197 = 35,46 gam

\(n_{Na}=\dfrac{4,6}{23}=0,2mol\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(4Na+O_2\underrightarrow{t^o}2Na_2O\)
0,2 0,3 0
0,2 0,05 0,1
0 0,25 0,1
Chất dư: \(O_2\) và có \(m_{O_2dư}=0,25\cdot32=8g\)
\(m_{Na_2O}=0,1\cdot62=6,2g\)
\(n_{Na}=\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{6,72}{22,4}=0,3mol\)
\(4Na+O_2\rightarrow2Na_2O\)
0,2 < 0,3 ( mol )
0,2 0,05 0,1 ( mol )
Chất còn dư là O2
\(m_{O_2\left(dư\right)}=n_{O_2\left(dư\right)}.M_{O_2\left(dư\right)}=\left(0,3-0,05\right).32=8g\)
\(m_{Na_2O}=n_{Na_2O}.M_{Na_2O}=0,1.62=6,2g\)

Chọn đáp án D.
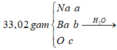
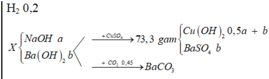
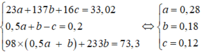
→ nOH- trong X = 0,28 + 0,18×2 = 0,64
→ nCO32- sinh ra = 0,64 - 0,45 = 0,19 > 0,18
→ nBaCO3 = 0,18
→ mBaCO3 = 0,18×197 = 35,46 gam.

Đáp án D
nNa = 4,6: 23 = 0,2 mol
Na + H2O → NaOH + 0,5H2
Mol 0,2 → 0,1
=> VH2 = 0,1.22,4 = 2,24 lit
2Na + 2H2O ---> H2 + 2NaOH
nH2 = 4,48/22,4 = 0,2mol
=>nNa = 0,4mol
=>mNa = 0,4.23 =9,2gam
9,2 gam