Cho 6,85 gam ba vào 500 gam dung dịch H2 SO4 1,96% Tính C phần trăm dung dịch thu được sau phản ứng biết d = 1,15 g ml Tính CM của dung dịch thu được ở trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al_2(SO_4)_3}=0,1.0,2=0,02(mol)\\ n_{KOH}=0,2.0,3=0,06(mol)\\ PTHH:Al_2(SO_4)_3+6KOH\to 2Al(OH)_3\downarrow+3K_2SO_4\)
Vì \(\dfrac{n_{Al_2(SO_4)_3}}{1}>\dfrac{n_{KOH}}{6}\) nên \(Al_2(SO_4)_3\) dư
\(a,n_{K_2SO_4}=\dfrac{1}{2}n_{KOH}=0,3(mol)\\ n_{Al(OH)_3}=\dfrac{1}{3}n_{KOH}=0,2(mol)\\ \Rightarrow m_{Al(OH)_3}=0,2.78=15,6(g)\\ C_{M_{K_2SO_4}}=\dfrac{0,3}{0,5}=0,6M\)
\(b,K_2SO_4\) ko tác dụng được với \(KOH\), bạn xem lại đề
thế dd X chứa gì
K2SO4 kh tác dụng đc mà Al2(SO4)3 tác dụng đc mà

Sửa lại câu c .
\(n_{H_2SO_4}=\dfrac{49.40}{100}:98=0,2\left(mol\right)\)
\(PTHH:\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
trc p/u : 0,3 0,2
p/u : 0,2 0,2 0,2 0,2
sau : 0,1 0 0,2 0,2
-> Fe dư
\(m_{ddFeSO_4}=0,3.56+49-0,4=65,4\left(g\right)\) ( ĐLBTKL )
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(C\%=\dfrac{30,4}{65,4}.100\%\approx46,48\%\)
PTHH :
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3 0,3 0,3
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(a,m_{Fe}=0,3.56=16,8\left(g\right)\)
\(b,C_M=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
\(c,n_{H_2SO_4}=\dfrac{\dfrac{49.40}{100}}{98}=0,2\left(mol\right)\)
\(\rightarrow n_{FeSO_4}=n_{H_2SO_4}=0,2\left(mol\right)\)
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(m_{ddFeSO_4}=49+\left(0,2.56\right)-0,2.2=59,8\left(g\right)\)( định luật bảo toàn khối lượng )
\(C\%=\dfrac{30,4}{59,8}.100\%\approx50,84\%\)

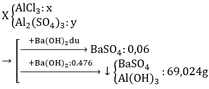
Cho Ba(OH)2 vào muối Al sẽ có 2TH sau:
TH1: kết tủa Al(OH)3 chưa bị hòa tan
Al3+ + 3OH– → Al(OH)3↓
→ nAl(OH)3 = nAl3+ → nAl(OH)3 = xn + 0,04n
TH2: kết tủa Al(OH)3 bị hòa tan một phần
Al3+ + 3OH– → Al(OH)3↓
(xn + 0,04n)→ 3(xn + 0,04n) (xn + 0,04n)
Al(OH)3 + OH– → AlO2– + 2H2O
0,952 – 3(xn + 0,04n) ←0,952
→ nAl(OH)3 = 4xn + 0,16n – 0,952

\(n_{Ba}=\dfrac{6,85}{137}=0,05\left(mol\right)\\ m_{H_2SO_4}=500.1,96\%=9,8\left(g\right)\\ PTHH:Ba+H_2SO_4\rightarrow BaSO_4+H_2\uparrow\\ LTL:0,05< 0,1\Rightarrow H_2SO_4.dư\)
\(n_{BaSO_4}=n_{H_2SO_4\left(pư\right)}=n_{Ba}=n_{H_2}=0,05\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
\(V_{dd}=\dfrac{500}{1,15}\approx434\left(ml\right)=0,434\left(l\right)\)
\(C_{MBaSO_4}=\dfrac{0,05}{0,434}=0,115M\\ C_{MH_2SO_4\left(dư\right)}=\dfrac{0,05}{0,434}=0,115M\)