Trong phòng thí nghiệm có 2 chất KMnO4 và KClO3 là nguyên liệu để điều chế khí O2. Để điều chế được 3,36 lit khí O2(đktc) thì dùng chất nào sẽ cần khối lượng nhỏ nhất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Dùng KClO3
PTHH: \(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\uparrow\)
Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow n_{KClO_3}=\dfrac{2}{15}\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=\dfrac{2}{15}\cdot122,5\approx16,33\left(g\right)\)

\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(\dfrac{a}{158}.............................\dfrac{a}{79}\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(\dfrac{a}{122.5}............\dfrac{3a}{245}\)
\(TC:\)
\(\dfrac{a}{79}>\dfrac{3a}{245}\)
=> Lượng Cl2 điều chế từ KMnO4 lớn nhất.

bạn không nói rõ là nguyên liệu nào thì sao chọn được. Nhưng nếu so sánh giữa KMnO4,KClO3,KNO3 và H2O2 thì chọn H2O2 nhé

a) \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,2<-------------------0,3
=> \(m_{KClO_3}=0,2.122,5=24,5\left(g\right)\)
b) \(n_{KClO_3}=\dfrac{490}{122,5}=4\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
4-------------->4---->6
=> \(m_{KCl}=4.74,5=298\left(g\right)\)
=> \(m_{O_2}=6.32=192\left(g\right)\)
2KClO3 \(\underrightarrow{t^o}\) 2KCl + 3O2
a, \(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\\ n_{KClO_3}=\dfrac{0,3.2}{3}=0,2mol\\ m_{KClO_3}=0,2.122,5=24,5g\)
b, \(n_{KClO_3}=\dfrac{490}{122,5}=4mol\)
\(\Rightarrow m_{KCl}=4.74,5=298g\)
\(n_{O_2}=\dfrac{4.3}{2}=6mol\\ m_{O_2}=6.32=192g\)

Giả sử cần điều chế 3,36lit O 2 tương đương với 0,15 mol O 2
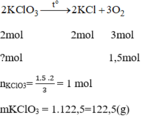
Số tiền mua 122,5g để điều chế 1,5mol O 2 :
0,1225.96000 = 11760 (đồng)
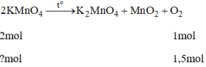
n K M n O 4 = 1,5 . 2 =3 mol
n K M n O 4 = 3.158 = 474 (g)
Số tiền mua 474g để điều chế 1,5 mol O 2 :
0,474.30000 = 14220(đồng)
Vậy để điều chế cùng 1 thể tích khí O 2 thì dùng K C l O 3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg K C l O 3 cao hơn nhưng thể tích khí O 2 sinh ra nhiều hơn.

PTHH :
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
1/3 0,5
\(2MnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
1 0,5
Vậy khi điều chế cùng lượng O2 ta dùng KClO3 lợi hơn vì với 1 mol KClO3 sẽ cho ra 1,5 mol O2 còn KMnO4 chỉ cho ra 0,5 mol O2
\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(m_{KClO_3}=122,5.\dfrac{1}{3}=\dfrac{245}{6}\approx40,8\left(g\right)\)
\(m_{KMnO_4}=158.1=158\left(g\right)\)

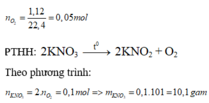
nO2 = 3,36/22,4 = 0,15 (mol)
PTHH:
2KClO3 -> (t°) 2KCl + O2
0,1 <------------------------ 0,15
2KNO3 -> (t°) 2KNO2 + O2
0,3 <--------------------------- 0,15
2HgO -> (t°) 2Hg + O2
0,3 <---------------------- 0,15
So sánh: 0,1 < 0,3 = 0,3
=> Dùng KClO3 thì sẽ tiết kiệm nhất
PTHH
2KClO3 -to-> 2KCl + 3O2
0,1--------------------------0,15
2KNO3 -to-> 2KNO2 + O2
0,3-----------------------------0,15
2HgO -to-> 2Hg + O2
0,3---------------------0,15
ta cho mỗi khí ở ccas pt là như nhau
n O2=\(\dfrac{3,36}{22,4}\)=0,15 mol
=> ta suy ra khối lg thấy KClO3 là tiết kiệm nhất
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,3<------------------------------0,15
2KClO3 --to--> 2KCl + 3O2
0,1<-----------------0,15
=> \(\left\{{}\begin{matrix}m_{KMnO_4}=0,3.158=47,4\left(g\right)\\m_{KClO_3}=0,1.122,5=12,25\left(g\right)\end{matrix}\right.\)
=> Dùng KClO3 sẽ cần khối lượng nhỏ hơn
chuẩn