Dẫn 11,2 lit hỗn 0 khí (đktc) gồm CH4 và C2
H4 đi qua bình đựng dung dịch nước brom dư. Sau khi phản ứng kết thúc, người ta thấy thoát ra 3,36 lit khí. a)Tính thành phần % theo thể tích mỗi khí trong hỗn hợp ban đầu? b) Tính thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn hỗn hợp khí trên? (Cho C = 12; H = 1; 0 = 16; Br = 80)

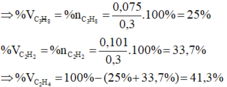

a) \(n_{CH_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
=> \(\%V_{CH_4}=\dfrac{3,36}{11,2}.100\%=30\%\)
=> \(\%V_{C_2H_4}=100\%-30\%=70\%\)
b) \(n_{C_2H_4}=\dfrac{11,2.70\%}{22,4}=0,35\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,15-->0,3
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,35-->1,05
=> nO2 = 0,3 + 1,05 = 1,35 (mol)
=> VO2 = 1,35.22,4 = 30,24 (l)