b) Xác định công thức phân tử của X, biết tỉ khối của X đối với H2 bằng 16.
Câu 6: Hòa tan hoàn toàn 11 gam hỗn hợp X gồm Al và Fe bằng dung dịch axit sunfuric loãng dư. Sau khi phản ứng kết thúc thu được 8,96 lít khí (đktc)
a) Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp X?
b) Tính khối lượng muối khan thu được?
c) Lượng khí Hiđro ở trên khử vừa đủ 23,2 gam oxit của kim loại M. Xác định công thức hóa học của oxit đó?
Câu 7: Hòa tan hết 4,8 gam hỗn hợp A gồm MgO, Fe2O3, CuO cần vừa đủ một lượng dung dịch chứa 5,84 gam HCl. Mặt khác, dẫn khí H2 dư qua 0,09 mol hỗn hợp A nung nóng thì sau phản ứng thu được 1,62 gam nước. Tính khối lượng mỗi chất trong 4,8 gam hỗn hợp A.

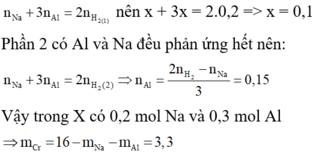


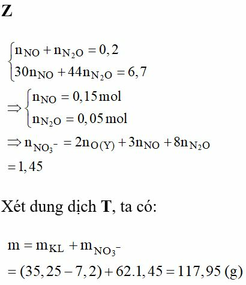
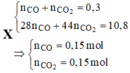
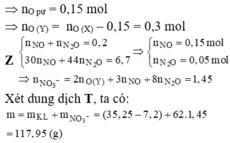
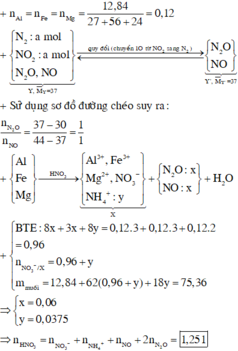
câu 7
MgO + 2HCl -> MgCl2 + H2O
x 2x
Fe2O3 + 6HCl -> 2FeCl3 + 3H2O
y 6y
CuO + 2HCl -> CuCl2 + H2O
z 2z
A--H2 dư----> MgO + H2O
Fe
Cu
Fe2O3 + 3H2 -> 2Fe + 3H2O
ky
CuO + H2 -> Cu + H2O
kz
nH2O=\(\dfrac{16,2}{18}\)0,09mol
Gọi nMgO=x, nFe2O3=y, nCuO=z (trong 4,8g hh A)
nMgO=kx, nFe2O3=ky, nCuO=kz (trong 0,09mol A)
=> kx+ky+kz =4,8
3ky + kz= 0,09=> 2ky = kx =>\(\left\{{}\begin{matrix}2y=x\\40x+160y+80z=4,8\\2x+6y+2z=\dfrac{5,84}{36,5}=0,16\end{matrix}\right.\)
+ x=0,02
=> mMgO= 0,8g
+y=0,01
=> mFe2O3=1,6g
+ z=0,03
=> mCuO=2,4g
Gọi x,y lần lượt là số mol của Al, Fe
nH2 = 8,9622,4=0,48,9622,4=0,4 mol
Pt: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
......x.................................0,5x...........1,5x
.....Fe + H2SO4 --> FeSO4 + H2
.......y..........................y............y
Ta có hệ pt: {27x+56y=111,5x+y=0,4⇔{x=0,2y=0,1{27x+56y=111,5x+y=0,4⇔{x=0,2y=0,1
% mAl = 0,2×2711.100%=49,1%0,2×2711.100%=49,1%
% mFe = 0,1×5611.100%=50,9%0,1×5611.100%=50,9%
mAl2(SO4)3 = 0,5x . 342 = 0,5 . 0,2 . 342 = 34,2 (g)
mFeSO4 = 152y = 152 . 0,1 = 15,2 (g)
Gọi CTTQ: MxOy
Pt: MxOy + yH2 --to--> xM + yH2O
0,4y0,4y<-------0,4
Ta có: 232,2=0,4y(56x+16y)232,2=0,4y(56x+16y)
⇔23,2=22,4xy+6,4⇔23,2=22,4xy+6,4
⇔22,4xy=16,8⇔22,4xy=16,8
⇔22,4x=16,8y⇔22,4x=16,8y
⇔xy=16,822,4=34⇔xy=16,822,4=34
Vậy CTHH của oxit: Fe3O4