Hỗn hợp X gồm Cu và Fe. Chia X thành 2 phần bằng nhau: Phần 1: Tác dụng với dung dịch H2SO4 loãng sinh ra 4,48 lít khí(đktc), Phần 2: Tác dụng với dung dịch H2SO4 đặc, nóng sinh ra 8,96 lít khí (đktc). Tính khối lương của X ban đâu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn C
Phần 1 chỉ có Fe phản ứng → nFe = nH2 = 0,1
Phần 2 có cả Fe và Cu phản ứng, mà H2SO4 đặc dư → Fe lên Fe3+ hết
BTE → 3nFe + 2nCu = 2x 0,4 → nCu = (0,8 – 0,3)/2 = 0,25
Vậy 0,5m = 0,1 x 56 + 0,25 x 64 = 21,6 → m = 43,2.

\(\text{Mỗi phần,gọi :} n_{Al} = a ; n_{Fe} = b ; n_{Cu} = c\\ \Rightarrow 27a + 56b + 64c = \dfrac{35,8}{2} = 17,9(1)\\ \text{Phần 1 : Al,Fe không phản ứng với axit đặc nguội}\\ Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O\\ n_{Cu} = c = n_{SO_2} = \dfrac{3,36}{22,4} = 0,15(2)\\ \text{Phần 2 : Cu không phản ứng với axit loãng}\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(3)\\ (1)(2)(3) \Rightarrow a = b = 0,1 ; c = 0,15\)
Suy ra :
\(m_{Al} = 0,1.2.27 = 5,4(gam)\\ m_{Fe} = 0,1.2.56 = 11,2(gam)\\ m_{Cu} = 0,15.64.2 = 19,2(gam)\)

Đáp án : C
P1 : nH2 = nFe = 0,1 mol
P2 : Gọi số mol của Fe và Cu trong P2 lần lượt là x và y
=> bảo toàn e : 3x + 2y = 2nSO2 = 0,8 mol
, mmuối = mCuSO4 + mFe2(SO4)3 = 200x + 160y = 56g
=> x = 0,2 ; y = 0,1 mol
Tỉ lệ mol Fe : Cu trong các phần không đổi
=>Trong P1 : nCu = 0,05 mol
Trong m gam X có: 0,3 mol Fe và 0,15 mol Cu
=> m = 26,4g

1)
- Xét phần 1:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,2<-------------------0,2
=> nFe = 0,2 (mol)
- Xét phần 2:
\(n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2-->0,6-------->0,1--------->0,3
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,3<----0,6<------0,3<-----0,3
=> nCu = 0,3 (mol)
m = 2.(0,2.56 + 0,3.64) = 60,8 (g)
2)
\(m_{H_2SO_4\left(bđ\right)}=\dfrac{200.98}{100}=196\left(g\right)\)
=> \(m_{H_2SO_4\left(sau.pư\right)}=196-98\left(0,6+0,6\right)=78,4\left(g\right)\)
mdd sau pư = \(\dfrac{60,8}{2}+200-0,6.64=192\left(g\right)\)
\(\left\{{}\begin{matrix}C\%_{\left(Fe_2\left(SO_4\right)_3\right)}=\dfrac{0,1.400}{192}.100\%=20,83\%\\C\%_{\left(CuSO_4\right)}=\dfrac{0,3.160}{192}.100\%=25\%\\C\%_{\left(H_2SO_4.dư\right)}=\dfrac{78,4}{192}.100\%=40,83\%\end{matrix}\right.\)

Chọn B
Phần I. Cho X tác dụng với HNO 3 đặc, nguội chỉ có Cu phản ứng.
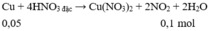
Phần II. Cho X tác dụng với H 2 SO 4 loãng, dư chỉ có Fe phản ứng
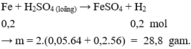

P1 :\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: nH2 = nFe = 0,1 mol
P2 :2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O (1)
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O (2)
Ta có: \(\dfrac{3}{2}.0,1\) + nSO2(2) = 0,4 mol
=> x = 0,1 ; y = 0,25 mol
Do chia 2 hỗn hợp X thành phần bằng nhau nên trong gam X có: 0,2 mol Fe và 0,5 mol Cu
=> \(\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,3.64}.100=36,84\%\)
%m Cu=63,16%


Gọi \(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Phần 1:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(Fe+H_2SO_{4l}\rightarrow FeSO_4+H_2\)
0,2 0,2
\(\Rightarrow n_{Fe}=0,2mol\Rightarrow m_{Fe}=0,2\cdot56=11,2g\)
Phần 2:
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4mol\)
\(BTe:2n_{Cu}+3n_{Fe}=2n_{SO_2}=0,8\)
\(\Rightarrow n_{Cu}=\dfrac{0,8-3\cdot0,2}{2}=0,1mol\)
\(\Rightarrow m_{Cu}=0,1\cdot64=6,4g\)
Vậy \(m_X=m_{Cu}+m_{Fe}=6,4+11,2=17,6g\)