Cho 5,4g kim loại M hóa trị III tác dụng vừa đủ với 395,2g dung dịch H2SO4 loãng. Dung dịch muối sau phản ứng có nồng độ 8,55% và thu được 0,6g H2. a/ Tìm tên kim loại? b/ Tính nồng độ % của dung dịch H2SO4 ban đầu? c/ nếu thay dung dịch H2SO4 bằng dung dịch HCl 1M thì phải dùng bao nhiêu ml để có thể hòa tan hết lượng kim loại M nói trên?
các bạn giúp minh nhá:) cám ơn mn nhiều nha

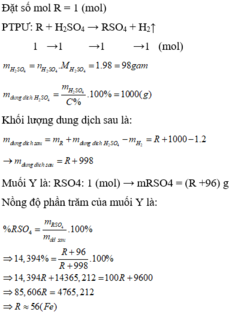
a)
\(n_{H_2}=\dfrac{0,6}{2}=0,3\left(mol\right)\)
PTHH: 2M + 3H2SO4 --> M2(SO4)3 + 3H2
0,2<----0,3<--------0,1<-------0,3
=> \(M_M=\dfrac{5,4}{0,2}=27\left(g/mol\right)\)
=> M là Al
b) \(C\%_{dd.H_2SO_4}=\dfrac{0,3.98}{395,2}.100\%=7,44\%\)
c)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2-->0,6
=> \(V_{dd.HCl}=\dfrac{0,6}{1}=0,6\left(l\right)=600\left(ml\right)\)
cảm ơn bạn nhiều nha:))