Cho hỗn hợp X gồm MgO, FeO, Fe2O3 và Fe3O4 có số mol bằng nhau. Lấy m gam X cho vào ống sứ chịu nhiệt, nung nóng rồi cho luồng khí CO đi qua ống, CO phản ứng hết. Toàn bộ khí CO2 bay ra khỏi ống đc hấp thụ hết vào bình đựng 100ml dung dịch Ba(OH)2 0.60M, thấy khối lượng dung dịch tăng so với dung dịch Ba(OH)2 ban đầu là 1.665 gam. Chất rắn Y còn lại trong ống sứ gồm 5 chất và có khối lượng 21 gam. Cho hỗn hợp Y tác dụng vs dung dịch HNO3 đun nóng, thu đc V lít khí NO ( sản phẩm khử duy nhất, đo ở đktc).
a, Viết phương trình phản ứng hóa học xảy ra.
b, Tính giá trị n, V và số mol HNO3 đem dùng ( biết lượng axit dư 20% so với lượng cần thiết

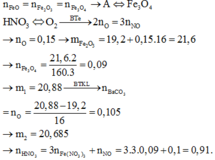
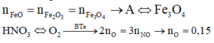
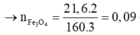
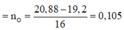

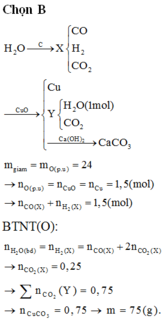
Quy đổi A chỉ gồm Fe3O4 + CO → 19,2 gam (Fe : x mol + O : y mol) + CO2
19,2 gam (Fe : x mol + O : y mol) + HNO3 → Fe(NO3)3 + NO + H2O
Ta có hệ phương trình
(1) 56x + 16y = 19,2
(2) ĐLBT mol e : 3x = 2y + 0,1*3
→ x = 0,27 ; y = 0,255 → n(Fe3O4) = 0,09 mol → m1 = 20,880 gam
→ n(CO2) = n(CaCO3) = 0,09*4 – 0,255 = 0,105 → m2 = 20,685 gam
n(HNO3) = 0,27*3 + 0,1 = 0,91 mol
Khối lượng dung dịch tăng nên tạo BaCO3 (a) và Ba(HCO3)2 (b)
nBa(OH)2 = a + b = 0,06
Δm = 44(a + 2b) – 197a = 1,665
->a = 0,015 và b = 0,045
nCO2 = a + 2b = 0,105
X gồm nMgO = nFeO = nFe2O3 = nFe3O4 = x
-->Quy đổi Y thành Mg (x), Fe (6x) và O (9x – 0,105)
=>mY = 24x + 56.6x + 16(9x – 0,105) = 21
-> x = 0,045
->mX = 22,68
Bảo toàn electron: 2nMg + 3nFe = 2nO + 3nNO
nNO = 0,1
->V = 2,24 lít
=>nHNO3 = 4nNO + 2nO = 1