axit clohidric ( HCL ) tác dụng với Magie cacbonat ( MgCO3 ) theo sơ đồ phản ứng sau :
HCL + MgCO3 ---> MgCl2 + CO2 + H2O
tính nồng độ % chất tan có trong dung dịch sau phản ứng khi có 100g dung dịch HCl 14,6% tác dụng với 50 g MgCO3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Giả sử có 100 gam dung dịch HCl 32,85% thì khối lượng HCl là 32,85 gam.
nHCl= 32 , 85 36 , 5 = 0,90 mol
- Gọi số mol của CaCO3 là x (mol). Phản ứng:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 (1)
x 2x x x
Từ (1) và đề ra: nHCldư = (0,90 - 2x) mol
Khối lượng dung dịch X sau phản ứng (1): 100 + 100x – 44x = (100 + 56x) gam
Theo đề ra: C%HCl = ( 0 , 90 - 2 x ) . 36 , 5 100 + 56 x . 100 % = 24,195% => x = 0,1 mol
Vậy sau p/ư (1) nHCl còn lại = 0,7mol
- Cho MgCO3 vào dung dịch X, có p/ư:
MgCO3 + 2HCl → MgCl2 + H2O + CO2 (2)
y 2y y y
Sau p/ư (2) nHCl dư = 0,7-2y
Khối lượng dung dịch Y là: (105,6 + 84y - 44y) gam hay (105,6 + 40y) gam
Từ (2) và đề ra: C%HCl trong Y = ( 0 , 7 - 2 y ) . 36 , 5 105 , 6 + 40 y . 100% = 21,11% => y = 0,04 mol
Dung dịch Y chứa 2 muối CaCl2, MgCl2 và HCl dư:
C%(CaCl2) = 0 , 1 . 111 107 , 2 . 100 % = 10 , 35 %
C%(MgCl2) = 0 , 04 . 95 107 , 2 . 100 % = 3 , 54 %

Đáp án B
Chọn 1 mol HCl ban đầu. Gọi n C a C O 3 = x
Có phản ứng: C a C O 3 + 2 H C l → C a C l 2 + C O 2 + H 2 O (1)
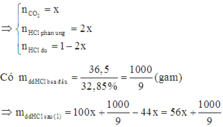
Do đó nồng độ phần trăm của HCl sau phản ứng (1) là:
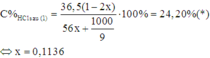
Do đó sau phản ứng (1) dung dịch X có mx = 117,47; nHCl dư = 0,7728
Gọi n M g C O 3 = y . Có phản ứng:
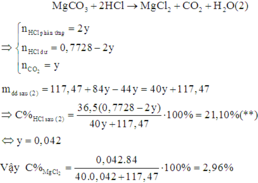
Do trong quá trình tính toán, ta có nhiều bước làm tròn nên dẫn đến sai số.
Khi đó ta sẽ chọn đáp án gần với kết quả tính được nhất.

PTHH: MgCO3 +2 HCl -> MgCl2 + CO2 + H2O
a) nMgCO3=8,4/84=0,1(mol)
=> nMgCl2=nMgCO3=0,1(mol) => mMgCl2=0,1.95=9,5(g)
b) nHCl=7,3/36,5=0,2(mol)
=> nCO2= 1/2. nHCl=1/2. 0,2=0,1(mol) => V(CO2,đktc)=0,1.22,4=2,24(l)
c) Thu khí CO2 ta thu bằng cách đặt đứng bình vì khí CO2 là khí nặng hơn không khí (44>29)

Câu 1:
\(a,PTHH:Mg+2HCl\to MgCl_2+H_2\\ b,m_{Mg}+m_{HCl}=m_{MgCl_2}+m_{H_2}\\ \Rightarrow m_{HCl}=9,5+0,2-2,4=7,3(g)\)
Câu 2:
\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\\ \Rightarrow m_{ZnCl_2}=13+14,6-0,4=27,2(g)\)
\(n_{HCl}=\dfrac{100.14,6\%}{36,5}=0,4\left(mol\right)\\ n_{MgCO_3}=\dfrac{50}{84}=\dfrac{25}{42}\left(mol\right)\\ PTHH:MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\\ Vì:0,4:2< \dfrac{25}{42}:1\\ \Rightarrow MgCO_3dư\\ \Rightarrow ddsau:MgCl_2\\n_{MgCO_3\left(p.ứ\right)}=n_{CO_2}= n_{MgCl_2}=\dfrac{n_{HCl}}{2}=\dfrac{0,4}{2}=0,2\left(mol\right)\\ m_{ddsau}=m_{MgCO_3\left(p.ứ\right)}+m_{ddHCl}-m_{CO_2}=0,2.84+100-0,2.44=108\left(g\right)\\ C\%_{ddMgCl_2}=\dfrac{0,2.95}{108}.100\approx17,593\%\%\)