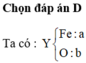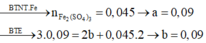Khử một oxit sắt bằng khí CO trong binh kín sau khi phản ứng kết thúc thu được chất rắn A và hỗn hợp khí B. Hòa tan chất rắn A trong 300g dung dịch axit H2SO4 49%, để kết tủa hoàn toàn dung dịch muối thu được cần dùng 500ml dung dịch Ba(OH)2 3M, đem kết tủa nung đến khối lượng không đổi thu được 376,5 g chất rắn. Mặt khác dẫn hỗn hợp khí B qua 500ml dung dịch Ca(OH)2 3,5M thì thu được 150 g kết tủa. Tìm công thức hóa học và tên gọi oxit sắt.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
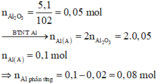
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
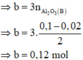
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
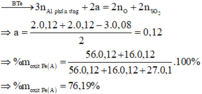

nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.
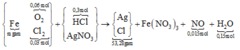
Ghép cụm có nH2O = nO trong oxit + 2nNO
→ nNO = 0,015 mol.
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa
→ về nguyên tố nAg trong tủa = 0,375 mol
Bảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.
→ Yêu cầu m = mFe = 0,12 × 56 = 6,72 gam.
Đáp án A

Đáp án A
Ta có nHCl cần dùng = 2∑nO trong oxit = 0,24 mol → ∑nHCl đã dùng (dư 25%) = 0,3 mol.
* Gộp cả quá trình có sơ đồ:
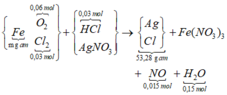
Ghép cụm NO3 bảo toàn O hoặc bảo toàn electron mở rộng ta có:
![]()
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa → về mặt nguyên tố ∑nAg trong tủa = 0,375 mol.
→ Bảo toàn nguyên tố N có
![]()
Theo đó, m gam Fe ban đầu tương ứng với 0,12 mol → m = 0,12 × 56 = 6,72 gam.

Đáp án : A
Giả sử Fe phản ứng tạo x mol Fe2+ và y mol Fe3+
=> Bảo toàn e : 2x + 3y = 0,3 mol
Khi cho chất rắn + HCl dư
=> tạo Fe2+ ; Fe3+ ; Cl-
=> nHCl pứ = 2nO = 0,24 mol
=> nHCl dùng = 0,3 mol
Phản ứng với AgNO3 đầu tiên Fe2+ phản ứng với H+ và NO3-
=> n F e 2 + p ư = 1 4 n H + d ư = 0,015 mol
=> Kết tủa : x mol Ag và (0,06 + 0,3) mol AgCl
=> 53,28 = 108x + 143,5.0,36 => x = 0,015
=> y = 0,09 mol
=> m = 56.( 0,015 + 0,015 + 0,09) = 6,72g

Đáp án A
nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.
Sơ đồ phản ứng
{ Fe (m gam) + (O2 0,06 mol; Cl2 0,03 mol)} + (HCl: 0,3 mol; AgNO3)
→ (Ag-Cl : 53,28 gam) + Fe(NO3)3 + NO 0,015 mol) + H2O 0,15 mol)
Ta có nH2O = nO trong oxit + 2nNO ||→ nNO = 0,015 mol.
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa → về nguyên tố nAg trong tủa = 0,375 mol
Bảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.
||→ m = mFe = 0,12 × 56 = 6,72 gam.
A:Vì
nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.Sơ đồ phản ứng
{ Fe (m gam) + (O2 0,06 mol; Cl2 0,03 mol)} + (HCl: 0,3 mol; AgNO3)
→ (Ag-Cl : 53,28 gam) + Fe(NO3)3 + NO 0,015 mol) + H2O 0,15 mol)
Ta có nH2O = nO trong oxit + 2nNO ||→ nNO = 0,015 mol.∑nCl = 0,36 mol đi hết vào 53,28 gam tủa → về nguyên tố nAg trong tủa = 0,375 molBảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.||→ m = mFe = 0,12 × 56 = 6,72 gam.