Một hỗn hợp A gồm 4 hiđrocacbon mạch hở là chất khí ở điều kiện thường. Khi cho m gam hỗn hợp A tác dụng vừa đủ với 150 ml dung dịch Br2 1M thì thoát ra hỗn hợp khí B gồm hai hiđrocacbon hơn kém nhau một nguyên tử cacbon. Đốt cháy hoàn toàn B thu được 6,72 lít khí CO2 và 9,00 gam nước. Nếu đốt cháy hoàn toàn m gam hỗn hợp A thu được 16,80 lít CO2 và 17,10 gam nước. Biết rằng các thể tích khí đo ở đktc. Xác định công thức phân tử của các chất trong A và tính phần trăm thể tích của chất có khối lượng phân tử lớn nhất trong A
:)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Gọi hợp chất bị brom hấp thụ là X, ankan bay ra là Y
Khi tham giam phản ứng với Br2 thì thể tích X là 160 ml, thể tích ankan Y là 240 ml tỉ lệ thể tích là nY : nX= 3:2
Có Mtb = 34
Đến đây thử từng đáp án .


Chọn A
Trong cùng điều kiện nhiệt độ và áp suất thì tỉ lệ thể tích chính là tỉ lệ số mol. Hai hiđrocacbon đồng đẳng liên tiếp, phân tử mỗi hiđrocacbon có ít hơn 2 liên kết pi, mạch hở → hidrocacbon hoặc là ankan hoặc là anken


Đáp án B
6 gam hhX + O2 → 0,4 mol CO2.
6 gam X + 0,2 mol Br2.
• TH1: Y là anken → nanken = 0,2 mol
→ số C trong Y = 0,4 : 0,2 = 2 → C2H4.
• TH2: Y là ankin → nankin = 0,2 : 2 = 0,1 mol
→ số C trong Y = 0,4 : 0,1 = 4
→ C4H6.

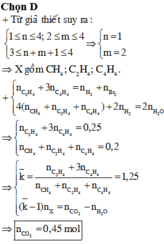

B gồm 2 hidrocacbon no mạch hở, hơn kém nhau 1 nguyên tử C
=> B gồm 2 ankan kế tiếp nhau
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\)
=> nankan = 0,5 - 0,3 = 0,2 (mol)
\(\overline{C}=\dfrac{0,3}{0,2}=1,5\)
Mà 2 ankan kế tiếp nhau
=> 2 hidrocacbon đó là CH4, C2H6 (thỏa mãn)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_6}=b\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}a+2b=0,3\\a+b=0,2\end{matrix}\right.\) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,1\left(mol\right)\end{matrix}\right.\)
\(n_{CO_2}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
\(n_{H_2O}=\dfrac{17,1}{18}=0,95\left(mol\right)\)
Gọi công thức chung của 2 hidrocacbon còn lại là \(C_xH_y\)
Gọi \(n_{C_xH_y}=t\left(mol\right)\)
Bảo toàn C: tx + 0,1.1 + 0,1.2 = 0,75
=> tx = 0,45
Bảo toàn H: ty + 0,1.4 + 0,1.6 = 0,95.2
=> ty = 0,9
=> \(\dfrac{x}{y}=\dfrac{0,45}{0,9}=\dfrac{1}{2}\) => y = 2x
=> Công thức chung của 2 hidrocacbon còn lại là \(C_xH_{2x}\)
=> 2 hidrocacbon còn lại là anken
\(n_{Br_2}=0,15.1=0,15\left(mol\right)\)
PTHH: CxH2x + Br2 --> CxH2xBr2
0,15<--0,15
\(\overline{C}=\dfrac{0,45}{0,15}=3\)
Mà 2 hidrocacbon ở thể khí
=> 2 hidrocacbon là C2H4, C4H8
Gọi \(\left\{{}\begin{matrix}n_{C_2H_4}=q\left(mol\right)\\n_{C_4H_8}=p\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}q+p=0,15\\2q+4p=0,45\end{matrix}\right.\) => \(\left\{{}\begin{matrix}q=0,075\left(mol\right)\\p=0,075\left(mol\right)\end{matrix}\right.\)
\(\%V_{C_4H_8}=\dfrac{0,075}{0,1+0,1+0,075+0,075}.100\%=21,429\%\)