Cho 8,4 gam Fe tác dụng vừa đủ với x lít khí oxi (đktc) sau phản ứng thu được y gam Fe3O4. Tính x, y ( Fe: 56, O:16)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : C
Fe + H2SO4 -> FeSO4 + H2
FeO + H2SO4 -> FeSO4 + H2O
=> nFe = n H 2 = 0,2 mol
=> nFeO = 0,3 – 0,2 = 0,1 mol
Bảo toàn Fe : nFe + nFeO = 3nFe3O4
=> n F e 3 O 4 = 0,1 mol
Bảo toàn O:
4 n F e 3 O 4 + n C O = 2 n C O 2 + n F e O
Vì n C O = n C O 2
=> nCO = 4.0,1 – 0,1 = 0,3 mol
=> V = 6,72 lit

nO2 = 2,24/22,4 = 0,1 (mol)
PTHH: 2R + O2 -> (t°) 2RO
nRO = 0,1 . 2 = 0,2 (mol)
M(RO) = 16,2/0,2 = 81 (g/mol)
<=> R + 16 = 81
<=> R = 65
<=> R là Zn
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{2,24}{22,4}=0,1mol\)
\(m_{O_2}=n_{O_2}.M_{O_2}=0,1.32=3,2g\)
Vì R hóa trị II nên PTHH là:
\(2R+O_2\rightarrow\left(t^o\right)2RO\)
2 1 2 ( mol )
0,2 0,1
Áp dụng định luật bảo toàn khối lượng, ta có:
\(m_R=16,2-3,2=13g\)
\(M_R=\dfrac{m_R}{n_R}=\dfrac{13}{0,2}=65\) g/mol
\(\Rightarrow R\) là kẽm (Zn)

\(n_{HCl}=\dfrac{58,4.15\%}{36,5}=0,24\left(mol\right)\\ Fe+2HCl\rightarrow\left(t^o\right)FeCl_2+H_2\\ n_{Fe}=n_{H_2}=\dfrac{0,24}{2}=0,12\left(mol\right)\\ \Rightarrow V1=V_{H_2\left(đktc\right)}=0,12.22,4=2,688\left(l\right)\\ x=m_{Cu}=m_{hhA}-m_{Fe}=15,68-0,12.56=8,96\left(g\right)\\ b,n_{Cu}=\dfrac{8,96}{64}=0,14\left(mol\right)\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ Cu+Cl_2\rightarrow\left(t^o\right)CuCl_2\\ n_{Cl_2}=\dfrac{3}{2}.n_{Fe}+n_{Cu}=\dfrac{3}{2}.0,12+0,14=0,32\left(mol\right)\\ \Rightarrow V2=V_{Cl_2\left(đktc\right)}=0,32.22,4=7,168\left(l\right)\\ y=m_{muối}=m_{AlCl_3}+m_{CuCl_2}=0,12.133,5+0,14.135=34,92\left(g\right)\)

bai 1 :
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
Pt : \(4H_2+Fe_3O_4\rightarrow3Fe+4H_2O|\)
4 1 3 4
0,4 0,1 0,3
\(n_{H2}=\dfrac{0,3.4}{3}=0,4\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,4.22,4=8,96\left(l\right)\)
\(n_{Fe3O4}=\dfrac{0,4.1}{4}=0,1\left(mol\right)\)
⇒ \(m_{Fe3O4}=0,1.232=23,2\left(g\right)\)
Chuc ban hoc tot
Minh xin loi ban nhe , ban bo sung nhiet do len phuong trinh giup minh

Đáp án B
Các phản ứng tạo kết tủa:
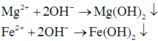
Dung dich X có ![]()
Dung dịch Y có ![]()
Mà ![]() nên OH-dư và
nên OH-dư và ![]()
Vậy ![]()

Đáp án C
Qui hỗn hợp về dạng:
Fe và O => mFe + mO = 12g (1)
nNO = 2,24: 22,4 = 0,1 mol
Bảo toàn e: 3nFe = 2nO + 3nNO => 3nFe – 2nO = 0,3 mol (2)
Từ (1,2) => nFe = 0,18 ; nO = 0,12 mol
=> nHNO3 = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64 mol
=> CM (HNO3) = 0,64: 0,2 = 3,2 M
m = mFe = 0,18.56 = 10,08g

a) \(n_{HCl}=\dfrac{360.18,25\%}{36,5}=1,8\left(mol\right)\)
H2 + CuO ------t°----->Cu + H2O
\(n_{CuO}=\dfrac{43,2}{80}=0,54\left(mol\right)\)
Gọi nCuO phản ứng = x (mol)
Theo đề bài
m chất rắn = \(m_{CuO\left(dư\right)}+m_{Cu}=\left(0,54-x\right).80+x.64=40\)
=> x = 0,2 mol
=> n H2 = 0,2 (mol)
=> m H2 = 0,2 . 2 =0,4 (g)
Fe + 2HCl → FeCl2 + H2 (*)
Theo PT : \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
=> Số mol HCl tác dụng với Fe3O4, Fe2O3, FeO là 1,8 - 0,4 = 1,4 mol
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
FeO + 2HCl → FeCl2 + H2O (3)
Bảo toàn nguyên tố H : \(n_{H_2O}.2=n_{HCl}.1\)
\(\Rightarrow n_{H_2O}=\dfrac{1,4}{2}=0,7\left(mol\right)\)
Áp dụng định luật bảo toàn khối lượng, ta có:
mhỗn hợp + mHCl = mmuối + mH2O + mH2
57,6 + 1,8.36,5 = mmuối + 0,7.18 + 0,4
mmuối= a = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)
b) Từ PT (*) => \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
Nếu trong X, nFe2O3=nFeO
=> Gộp 2 oxit trên thành Fe3O4
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
\(n_{Fe_3O_4}=\dfrac{57,6-0,2.56}{232}=0,2\left(mol\right)\)
\(n_{FeCl_3}=2n_{Fe_3O_4}=0,4\left(mol\right)\)
\(n_{FeCl_2}=n_{Fe_3O_4}=0,2\left(mol\right)\)
\(m_{ddsaupu}=57,6+360-0,4=417,2\left(g\right)\)
=> \(C\%_{FeCl_3}=\dfrac{0,4.162,5}{417,2}.100=15,58\%\)
\(C\%_{FeCl_2}=\dfrac{0,2.127}{417,2}.100=6,09\%\)
Ta có: \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(pthh:3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\)
0,15 -> 0,1 -------> 0,05 (mol)
\(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=0,1.22,4=2,24\left(lít\right)\\m_{Fe_3O_4}=0,05.232=11,6\left(g\right)\end{matrix}\right.\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\\ n_{O_2}=\dfrac{2.n_{Fe}}{3}=\dfrac{2.0,15}{3}=0,1\left(mol\right)\\ n_{Fe_3O_4}=\dfrac{n_{Fe}}{3}=\dfrac{0,15}{3}=0,05\left(mol\right)\\ \Rightarrow x=22,4.0,1=2,24\left(l\right)\\ y=232.0,05=11,6\left(g\right)\)