Cho 0,325 hỗn hợp gồm NaCl và KCl được hòa tan vào nước. Sau đó tác dụng với dung dịch AgNO3, ta được 1 kết tủa, sấy khô đến khối lượng không đổi cân nặng 0,717 g. Thành phần phần trăm về khối lượng các chất trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi a ,b là số mol của NaCl và KCl.(Khi vào nước tạo dd thì số mol chấ tan không đổi )
NaCl + AgNO3 ----. AgCl + NaNO3 (1)
a mol ------------> a mol
KCl + AgNO3 -----> AgCl + KNO3 (2)
b mol ------------> b mol
ta có :
mNaCl + m KCl = 0,325
<=> 58,5 a + 74,5 b = 0,325 (*)
m AgCl PƯ1 + m AgCl PƯ2 = 0,717
<=> 143,5a + 143,5b = 0,717 (**)
ừ (*) và (**) được hệ phương rình. Giải ra được a = 0,003 => m NaCl = 0,1755 --> 54,2 %
b = 0,002 => m KCl = 0,149 --> 45,8%
Gọi a ,b là số mol của NaCl và KCl.(Khi vào nước tạo dd thì số mol chấ tan không đổi )
NaCl + AgNO3 ----. AgCl + NaNO3 (1)
a mol ------------> a mol
KCl + AgNO3 -----> AgCl + KNO3 (2)
b mol ------------> b mol
ta có :
mNaCl + m KCl = 0,325
<=> 58,5 a + 74,5 b = 0,325 (*)
m AgCl PƯ1 + m AgCl PƯ2 = 0,717
<=> 143,5a + 143,5b = 0,717 (**)
ừ (*) và (**) được hệ phương rình. Giải ra được a = 0,003 => m NaCl = 0,1755 --> 54,2 %
b = 0,002 => m KCl = 0,149 --> 45,8%

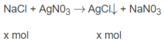
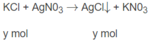
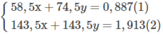
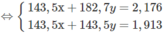
⇒ y = 6,71. 10 - 3 mol
Khối lượng KCl là : 74,5. 6,71. 10 - 3 = 0,5(g) KCl
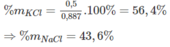

Đáp án : A
Fe;Fe2O3 -> FeCl2;FeCl3 -> Fe(OH)2;Fe(OH)3 -> Fe2O3
Bảo toàn Fe : 2nFe2O3 sau = nFe + 2nFe2O3 ban đầu
=> nFe2O3 sau = 0,2 mol
=> m = 32g

Câu 1:
Gọi số mol NaCl, KCl là a, b (mol)
=> 58,5a + 74,5b = 6,81 (1)
\(n_{AgCl}=\dfrac{14,35}{143,5}=0,1\left(mol\right)\)
Bảo toàn Cl: a + b = 0,1 (2)
(1)(2) => a = 0,04 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}m_{NaCl}=0,04.58,5=2,34\left(g\right)\\m_{KCl}=0,06.74,5=4,47\left(g\right)\end{matrix}\right.\)
Câu 2:
Gọi số mol MgCl2, KCl là a, b (mol)
=> 95a + 74,5b = 3,93 (1)
25ml dd A chứa \(\left\{{}\begin{matrix}MgCl_2:0,05a\left(mol\right)\\KCl:0,05b\left(mol\right)\end{matrix}\right.\)
nAgNO3 = 0,05.0,06 = 0,003 (mol)
=> nAgCl = 0,003 (mol)
Bảo toàn Cl: 0,1a + 0,05b = 0,003 (2)
(1)(2) => a = 0,01 (mol); b = 0,04 (mol)
\(\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,01.95}{3,93}.100\%=24,173\%\\\%m_{KCl}=\dfrac{0,04.74,5}{3,93}.100\%=75,827\%\end{matrix}\right.\)

Chúc bạn học tốt !!!
\(m_{hh}=74.5a+58.5b=26.6\left(g\right)\left(1\right)\)
\(n_{AgCl}=\dfrac{57.4}{143.5}=0.4\left(mol\right)\)
\(KCl+AgNO_3\rightarrow KNO_3+AgCl\)
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\)
\(n_{AgCl}=a+b=0.4\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=b=0.2\)
\(m_{dd\left(saupư\right)}=26.6+500-57.4=469.2\left(g\right)\)
\(C\%_{KNO_3}=\dfrac{0.2\cdot101}{469.2}\cdot100\%=4.31\%\)
\(C\%_{NaNO_3}=\dfrac{0.2\cdot85}{469.2}\cdot100\%=3.62\%\)


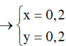
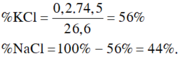

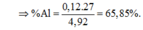
\(Đặt:\left\{{}\begin{matrix}n_{NaCl}=x\left(mol\right)\\n_{KCl}=y\left(mol\right)\end{matrix}\right.\\ Theođề:\Rightarrow\left\{{}\begin{matrix}58,5x+74,5=0,325\\x+y=\dfrac{0,717}{143,5}=0,005\left(BTNT\left(Cl\right)\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,003\\y=0,002\end{matrix}\right.\\ \Rightarrow m_{NaCl}=0,1755\left(g\right);m_{KCl}=0,149\left(g\right)\\ \Rightarrow\%NaCl=54,2\%,\%KCl=45,8\%\)