Nguyên tố R có công thức oxit cao nhất là R2O7. Trong hợp chất khí với Hiđrô khối lượng của nguyên tố R chiếm 97,26%. Nguyên tố R có số hiệu nguyên tử là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Oxit cao nhất là R2O7 => Hóa trị cao nhất của R là 7 => Hóa trị của R trong hợp chất khí với hiđro = 8 - 7= 1 => Công thức hợp chất khí của R với hiđro là RH

Hợp chất khí của R với hiđro có công thức phân tử là RH3.
Hợp chất oxit cao nhất của nguyên tố R là R2O5
Ta có \(\%O=\dfrac{16.5}{2R+16.5}.100=56,34\\ \Rightarrow R=31\left(Photpho-P\right)\\ \Rightarrow Z_R=SốE=15\)

Chọn A
Công thức oxit ứng với hóa trị cao nhất của R là R 2 O 5
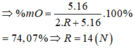
Dạ cho em hỏi là 74,07 phần trăm suy ra như thế nào vậy ạ? Em cảm ơn.

Đáp án : B
Qui tắc bát tử : Do số hóa trị trong hợp chất với H là 3
=> Số hóa trị trong hợp chất oxit cao nhất là 8 – 3 = 5
=> R2O5 => %mO(oxit) = 5 . 16 2 R + 5 . 16 . 100 % = 74 , 07 %
=> R = 14 (N)
=> B

Đáp án A
Hướng dẫn %R = 100% - %O = 100% - 74,07% = 25,93%
Hợp chất khí với Hidro là RH3 => b = 3
a + b = 8 => a = 5
Công thức Oxit cao nhất là R2O5
![]() = 2.MR =
= 2.MR = ![]() <=> 2.MR = 28 <=> MR =
<=> 2.MR = 28 <=> MR = ![]() = 14 => R là Nitơ
= 14 => R là Nitơ
CTHH hợp chất với hidro là RH
Có \(\dfrac{M_R}{M_R+1}.100\%=97,26\%\)
=> MR = 35,5(Cl)
=> R là Cl, có số hiệu nguyên tử là 17