Điện phân 2l dung dịch natri clorua 2M có màng ngăn biết hiệu suất quá trình là 85% khối lượng NaOH thu được là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
ne = It/F = 5.(96,5.60)/96500 = 0,3 mol
nCl- (0,5) > ne (0,3) => Cl- chưa bị điện phân ở anot.
Giả sử Cu2+ chưa bị điện phân hết => nCu = 0,3/2 = 0,15 mol
nCl2 = 0,3/2 = 0,15 mol
m dung dịch giảm = mCu+mCl2 = 0,15.64 + 0,15.71 = 20,15 gam => Loại
=> Cu2+ bị điện phân hết, H2O đã bị điện phân ở catot.
Catot:
Cu2+ + 2e → Cu
x → 2x →x
H2O + 1e → OH- + 0,5H2
0,3-2x → 0,15-x
Anot:
Cl- - 1e → 0,5Cl2
0,3→ 0,15
m dung dịch giảm = mCu + mH2 + mCl2 => 17,15 = 64x + 2(0,15-x) + 0,15.71 => x = 0,1mol
=> a = 0,1/0,5 = 0,2 mol/lít

Dd có 0,5a mol CuSO4 và 0,5 mol NaCl.
Trong quá trình điện phân giả sử xảy ra :
+ Catot: Cu2+ → + 2e Cu
2H2O + 2e → 2OH- + H2
+ Anot: 2Cl- → Cl2 + 2e
ne trao đổi = 0,3 mol
=> nCl2= 0,15 mol ; nCu= 0,5a mol ; nH2= (0,3-a) mol
m giảm = m Cl2 + mCu + mH2
=> 17,15 = 71.0,15 + 64.0,5a + 2(0,3-a) => a=0,2 M
=>A

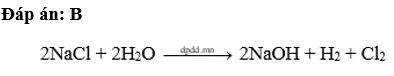
2NaCl +2H2O→2NaOH+H2↑+Cl2↑
H%=80=\(\frac{2n_{Cl_2}}{n_{Nacl}}\) →mCLo

20 tấn = 20 000 kg
\(m_{NaCl} = 20 000.90\% = 18000(kg)\\ n_{NaCl} = \dfrac{18000}{58,5}= \dfrac{4000}{13}(kmol)\\ n_{NaCl\ pư} = \dfrac{4000}{13}.65\% = 200(kmol)\\ 2NaCl + 2H_2O \xrightarrow{đpdd} 2NaOH + Cl_2 + H_2\\ n_{Cl_2} = \dfrac{1}{2}n_{NaCl} = 100(kmol)\\ V_{Cl_2} = 100.22,4 = 2240(m^3)\)
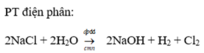
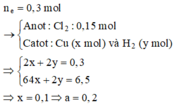
\(n_{NaCl}=2.2=4\left(mol\right)\)
=> \(n_{NaCl\left(pư\right)}=\dfrac{4.85}{100}=3,4\left(mol\right)\)
PTHH: 2NaCl + 2H2O --> 2NaOH + H2 + Cl2
3,4-------------------->3,4
=> mNaOH = 3,4.40 = 136(g)