Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Tính khối lượng sắt đã phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left\{{}\begin{matrix}n_{Cu\left(NO_3\right)_2}=0,2.0,1=0,02\left(mol\right)\\n_{AgNO_3}=0,2.0,1=0,02\left(mol\right)\end{matrix}\right.\)
PTHH: Fe + 2AgNO3 --> Fe(NO3)2 + 2Ag
0,01<---0,02--------->0,01---->0,02
Fe + Cu(NO3)2 --> Fe(NO3)2 + Cu
a<--------a------------->a----->a
=> 100 - 56(0,01+a) + 0,02.108 + 64a = 101,72
=> a = 0,015
=> nFe = 0,015 + 0,01 = 0,025 (mol)
=> mFe = 0,025.56 = 1,4(g)

Giải thích: Đáp án C
nCu2+ = nCu(NO3)2 = 0,2 mol
Fe + Cu2+ -> Fe2+ + Cu
1 mol Fe phản ứng tạo 1 mol Cu => mtăng = 64 – 56 = 8g
=> nFe pứ = (101,2 – 100)/8 = 0,15 mol
=> mFe pứ = 8,4g

Đáp án A
Nếu Mg còn dư trong phản ứng
=> mthanh hợp kim tăng = (64-24).0,075=3g > 1,16 g
=> Chứng tỏ Mg phản ứng hết.
Đặt số mol Mg và Fe phản ứng lần lượt là x, y.
=> mthanh hợp kim tăng =x(64-24)+y(64-56)=1,16g
Có ![]()
=> NaOH phản ứng với Y còn dư => 5 gam chất rắn gồm MgO, Fe2O3, có thể có CuO
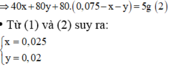
Đặt số mol Al và Fe còn dư lần lượt là a, b
=> mthanh hợp kim = 108a+24.0,025+56.(0,02+b)=8,8g
→ BTe a + 3 b + 2 . ( 0 , 025 + 0 , 02 ) = 2 . n S O 2 = 2 . 2 , 576 22 , 4 = 0 , 23 m o l


Đáp án C
Ta cớ pứ: Fe + Cu2+ → Fe2+ + Cu.
Đặt nFepứ = a ⇒ nCu = a.
⇒ mCu – mFe pứ = 0,4 Û 8a = 0,8 Û a = 0,05.
⇒ mFeSO4 = 0,05×152 = 7,6 gam

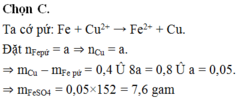
đaNG ĐỊNH TRẢ LỜI
Nhúng một thanh sắt nặng 100 gam vào 100ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một hời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam( giả thiết các kim loại tạo thành đều bám hết vào thanh sắt ). Khối lượng sắt đã phản ứng là 1,40gam