Nung nóng 2,4 g hỗn hợp CuO và một oxit sắt (FexOy), rồi cho luồng khí H2 đi qua cho
đến khi khử hết các oxit thì thu được 1,76 g chất rắn. Nếu hoà tan chất rắn đó bằng dung dịch
HCl dư thì thấy có 0,448 lít khí H2 (đktc) thoát ra. Xác định công thức của oxit sắt đó? Cho biết số mol của 2 oxit trong hỗn hợp bằng nhau
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,04<-----------------------0,04
\(m_{Cu}=3,52-0,04.56=1,28\left(g\right)\)
Bảo toàn O: \(\left\{{}\begin{matrix}n_{O\left(oxit\right)}=\dfrac{4,8-3,52}{16}=0,08\left(mol\right)\\n_{O\left(CuO\right)}=n_{Cu}=\dfrac{1,28}{64}=0,02\left(mol\right)\end{matrix}\right.\)
=> \(n_{O\left(Fe_xO_y\right)}=0,08-0,02=0,06\left(mol\right)\)
PTHH:CuO + H2 --to--> Cu + H2O
0,02<--------------0,02
=> \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,02.80}{4,8}.100\%=33,33\%\\\%m_{Fe_xO_y}=100\%-33,33\%=66,67\%\end{matrix}\right.\)
b, CTHH là FexOy
=> x : y = 0,04 : 0,06 = 2 : 3
=> CTHH là Fe2O3

a) A gồm Cu, Fe
\(n_O=\dfrac{39,2-29,6}{16}=0,6\left(mol\right)\)
=> \(n_{H_2O}=0,6\left(mol\right)\)
=> \(n_{H_2}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
b)
Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_xO_y}=b\left(mol\right)\end{matrix}\right.\)
=> 80a + b(56x + 16y) = 39,2
=> 80a + 56bx + 16by = 39,2 (1)
nO = 0,6 (mol)
=> a + by = 0,6
=> 80a + 80by = 48 (2)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,3<-------------------0,3
=> nFe = bx = 0,3 (mol)
(2) - (1) => 64by - 56bx = 8,8
=> by = 0,4
Xét \(\dfrac{bx}{by}=\dfrac{x}{y}=\dfrac{0,3}{0,4}=\dfrac{3}{4}\)
=> CTHH: Fe3O4
Có: \(\left\{{}\begin{matrix}80a+232b=39,2\\a+4b=0,6\end{matrix}\right.\)
=> a = 0,2; b = 0,1
=> \(\left\{{}\begin{matrix}m_{CuO}=0,2.80=16\left(g\right)\\m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\end{matrix}\right.\)

Đáp án D
Vì dung dịch D chỉ chứa một chất tan duy nhất và chất rắn G chỉ gồm một chất nên dung dịch D chứa NaAlO2 và G chứa CuO.
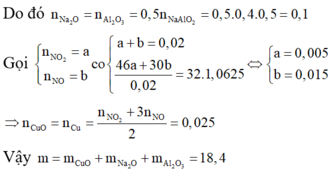

khử hoàn toàn 24 g hoá học CuO và oxit sắt bằng hidro dư đun nóng .sau phản ứng thu được 1,76 g chất rắn . hoà tan chất rắn vừa thu được bằng dung dịch axit HCl dư.khi phản ứng kết thúc thu được 0,448 l khí H2 ở điều kiện tiêu chuẩn
a)xác định công thức phân tử oxit sắt

1.Đưa que đóm đang cháy vào 4 chất khí: O2 bùng cháy sáng
Còn lại 3 chất khí CO,CO2,H2
Sục 3 chất khí vào dd \(Ca\left(OH\right)_2\)
-CO2: xuất hiện kết tủa trắng
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
-H2,CO: không hiện tượng
Đưa 2 chất khí đi qua CuO ở nhiệt độ thích hợp và Ca(OH)2
-CO2: kết tủa trắng
-H2: không hiện tượng
\(CuO+CO\rightarrow\left(t^o\right)Cu+CO_2\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2\)
2.
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02mol\)
\(Fe+HCl\rightarrow FeCl_2+H_2\)
0,02 0,02 ( mol )
\(m_{Fe}=0,02.56=1,12g\)
\(\Rightarrow m_{Cu}=1,76-1,12=0,64g\)
\(n_{Cu}=\dfrac{0,64}{64}=0,01mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,01 0,01 ( mol )
\(m_{CuO}=0,01.80=0,8g\)
\(\Rightarrow m_{Fe_xO_y}=2,4-0,8=1,6g\)
\(Fe_xO_y+yH_2\rightarrow\left(t^o\right)xFe+yH_2O\)
\(\dfrac{1,6}{56x+16y}\) -----> \(\dfrac{1,6x}{56x+16y}\) ( mol )
Ta có:
\(\dfrac{1,6x}{56x+16y}=0,02\)
\(\Leftrightarrow1,6x=1,12x+0,32y\)
\(\Leftrightarrow3x=2y\)
\(\Leftrightarrow x=2;y=3\)
\(\Rightarrow CTHH:Fe_2O_3\)
\(\%m_{Fe_2O_3}=\dfrac{1,6}{2,4}.100=66,67\%\)
\(\%m_{CuO}=100\%-66,67\%=33,33\%\)

a)
Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_xO_y}=b\left(mol\right)\end{matrix}\right.\)
=> 80a + b(56x + 16y) = 4,8 (1)
PTHH: CuO + H2 --to--> Cu + H2O
a------------->a
FexOy + yH2 --to--> xFe + yH2O
b----------------->bx
=> 64a + 56bx = 3,52 (2)
PTHH: Fe + 2HCl --> FeCl2 + H2
bx-------------------->bx
=> \(bx=\dfrac{0,892}{22,4}\approx0,04\left(mol\right)\)
(2) => a = 0,02 (mol)
(1) => by = 0,06
Xét \(\dfrac{bx}{by}=\dfrac{x}{y}=\dfrac{0,04}{0,06}=\dfrac{2}{3}\)
=> CTPT: Fe2O3
=> b = 0,02 (mol)
\(\left\{{}\begin{matrix}m_{CuO}=0,02.80=1,6\left(g\right)\\m_{Fe_2O_3}=0,02.160=3,2\left(g\right)\end{matrix}\right.\)
b) CTPT: Fe2O3

nH2= 0,448/22,4= 0,02(mol)
PTHH :
CuO + H2 -tdo--> Cu + H20
FexOy + yH2 -tdo-> xFe + yH20
Cu + HCl --> k pu
Fe + 2HCl ---> FeCl2 + H2
0,02 -- 0,04---> 0,02 --- 0,02 (mol)
mFe = 0,02 .56= 1,12(g)
=> mCu = 1,76 - 1,12= 0,64(g)
n Cu = 0,64 /64 =0,01(mol)
PTHH :
CuO + H2 -tdo-> Cu + H20
0,,01 --0,01 ----> 0,01(mol)
mCuO= 0,01 . 80 = 0,8(g)
=> mFexOy = 2,4-0,8= 1,6(g)
PTHH :
FexOy + yH2 ---> xFe + yH20
56x+ 16y ---------> 56x
1,6 (g) -------------> 1,12(g)
<=> 1,6 .56x = 1,12( 56x + 16y)
<=> 89,6x = 62,72 x + 17,92y
<=> 89,6x - 62,72x = 17,92y
<=> 26,88 x = 17,92y
=> x/y= 17,92 / 26,88 =2/3
Vậy công thức đúng là Fe203.