Oxi hóa cháy hoàn toàn 11,9 gam Zn và Al cần vừa đủ 5,6 lít hỗn hợp Cl2 và O2 (đktc) có khối lượng 11,9 gam. Khối lượng Al là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án B
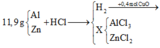
nH2 = nCuO = 0,4 (mol)
BTNT H: nHCl = 2nH2 = 0,8 (mol)
BTKL: mmuối = mAl+Zn + mCl- = 11,9 + 0,8.35,5 = 40,3 (g)

Đáp án A
Số mol các chất là:
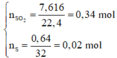
Sơ đồ phản ứng:
Al Zn ⏟ 11 , 9 g a m + H 2 S O 4 ( đ ặ c ) → Al 2 ( SO 4 ) 3 ZnSO 4 ⏟ M u ố i + S O 2 ⏟ 0 , 34 mol S ⏟ 0 , 02 m o l + H 2 o
Áp dụng công thức của bài toán kim loại tác dụng với H2SO4 đặc ta có:

má ơi tốc độ thân thánh thế em? Em tự làm nhanh hơn anh gõ máy

2Al + 3H2SO4 →Al2(SO4)3 + 3H2 (1)
Zn + H2SO4 →ZnSO4 + H2 (2)
a;nH2=\(\dfrac{8,96}{22,4}\)=0,4(mol)
Đặt nAl=a
nZn=b
Ta có:
\(\left\{{}\begin{matrix}27x+65y=11,9\\1,5x+y=0,4\end{matrix}\right.\)
=>a=0,2;b=0,1
mAl=27.0,2=5,4(g)
%mAl=\(\dfrac{5,4}{11,9}.100\)=54,4%
%mZn=54,6%
Ta có kim loại + H2SO4 → muối + H2
nH2 = 0,4 mol
Bảo toàn nguyên tố H có nH2 = nH2SO4 = 0,4 mol
Bảo toàn khối lượng có mkim loại + mH2SO4 = mH2 + mmuối → 11,9 + 0,4.98 = 0,4.2 + m → m = 50,3

Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\) => 65a + 56b + 27c = 10,65 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> \(n_{H_2}=a+b+1,5c=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) (2)
PTHH: Zn + Cl2 --to--> ZnCl2
2Fe + 3Cl2 --to--> 2FeCl3
2Al + 3Cl2 --to--> 2AlCl3
=> \(n_{Cl_2}=a+1,5b+1,5c=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\\c=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Al}=0,05.27=1,35\left(g\right)\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10,65}.100\%=61,033\%\\\%m_{Fe}=\dfrac{2,8}{10,65}.100\%=26,291\%\\\%m_{Al}=\dfrac{1,35}{10,65}.100\%=12,676\%\end{matrix}\right.\)
b) nHCl = 2a + 2b + 3c = 0,45 (mol)
=> mHCl = 0,45.36,5 = 16,425 (g)
=> \(a\%=C\%=\dfrac{16,425}{200}.100\%=8,2125\%\)
c) mdd sau pư = 10,65 + 200 - 0,225.2 = 210,2 (g)
=> \(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{210,2}.100\%=6,47\%\\C\%_{FeCl_2}=\dfrac{0,05.127}{210,2}.100\%=3,02\%\\C\%_{AlCl_3}=\dfrac{0,05.133,5}{210,2}.100\%=3,176\%\end{matrix}\right.\)

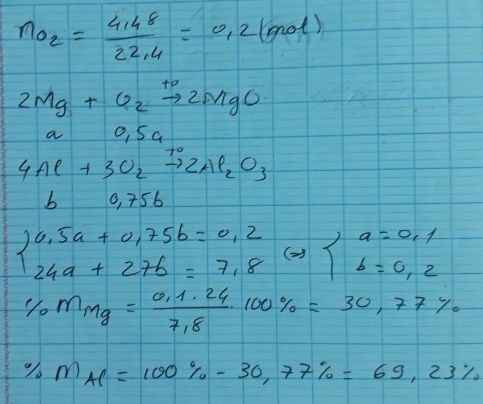




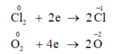

Giúp em với
Có \(\left\{{}\begin{matrix}71.n_{Cl_2}+32.n_{O_2}=11,9\\n_{Cl_2}+n_{O_2}=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.=>\left\{{}\begin{matrix}n_{Cl_2}=0,1\\n_{O_2}=0,15\end{matrix}\right.\)
Gọi số mol Zn, Al là a, b
=> 65a + 27b = 11,9
Al0-3e-->Al+3
b->3b
Zn0-2e-->Zn+2
a-->2a
Cl20 +2e--> 2Cl-
0,1->0,2
O20 +4e--> 2O-2
0,15->0,6
Bảo toàn e: 2a + 3b = 0,8
=> a = 0,1 ; b = 0,2
=> mAl = 0,2.27 = 5,4 (g)