Đốt cháy hoàn toàn một hidrocacbon X ở thể khí thu được 0,14 mol CO2 và 1,89g H2O. Tìm CTPT và CTCT của X biết X có thể trùng hợp tạo thành cao su?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

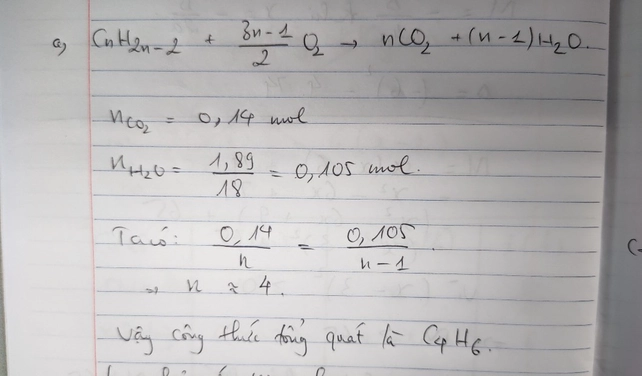
 Bạn tham khảo nhé!
Bạn tham khảo nhé!

Bài 1 :
\(n_{H_2O}>n_{CO_2}\Rightarrow X:ankan\)
\(Đặt:CTHH:C_nH_{2n+2}\)
\(\dfrac{n}{2n+2}=\dfrac{0.1}{0.3}\Rightarrow n=2\)
\(Vậy:Xlà:C_2H_6\left(etan\right)\)
Bài 1
\(n_{CO_2} < n_{H_2O} \to\) X là ankan (CnH2n+2)
\(n_X = n_{H_2O} - n_{CO_2} = 0,15 - 0,1 = 0,05(mol)\)
Suy ra: \(n = \dfrac{n_{CO_2}}{n_X} = \dfrac{0,1}{0,05} = 2\)
Vậy X là C2H6(etan)
Bài 2 :
Hỗn hợp có dạng CnH2n+2
\(n_{hỗn\ hợp} = \dfrac{4,48}{22,4} = 0,2(mol)\\ n_{H_2O} = \dfrac{18}{18} = 1(mol)\\ \Rightarrow n + 2 = \dfrac{2n_{H_2O}}{n_{hh}} = 5\\ Suy\ ra\ n = 3\)
\(\Rightarrow n_{CO_2} = 3n_{hh} = 0,2.3 = 0,6(mol)\\ \Rightarrow V = 0,6.22,4 = 13,44(lít)\)

X + O2 -- (t^o) -- > CO2 và H2O
X gồm có C và H
nCO2 = 35,2 : 44 = 0,8 (mol)
-- > nC= 0,8(mol)
nH2O = 21,6 : 18 = 1,2(mol)
--> nH = 1,2 . 2 = 2,4 (mol)
mC= 0,8 . 12 = 9,6(g)
mH = 2,4 . 1 = 2,4(g)
h/c X = mC + mH = 12g = m hh
--> h/c X không có nguyên tử Oxi
Gọi CTHH đơn giản của X là CxHy
ta có : nC : nH = 0,8 : 2,4 = 1 : 3
=> CTĐG giản X là CH3
ta có : (CH3)n = 30
15.n=30
=> n= 2
Vậy CTHH của X là C2H6
CTCT của X là: CH3 - CH3

$n_X = \dfrac{2,8}{22,4} = 0,125(mol)$
$n_{CO_2} = \dfrac{8,4}{22,4} = 0,375(mol)$
$n_{H_2O} = \dfrac{6,75}{18} = 0,375(mol)$
Bảo toàn nguyên tố C, H :
$n_C = n_{CO_2} = 0,375(mol) ; n_H = 2n_{H_2O} = 0,75(mol)$
Suy ra :
Số nguyên tử C = $\dfrac{0,375}{0,125} = 3$
Số nguyên tử H = $\dfrac{0,75}{0,125} = 6$
Vậy CTPT là $C_3H_6$
CTCT : $CH_2=CH-CH_3$

\(Coi\ n_B = 1(mol) \\ n_{CO_2} = 1.30\% =0,3(mol) ; n_{H_2O} = 1.20\% = 0,2(mol)\\ A: C_nH_{2n+2-2k}\\\ n_C = n_{CO_2} = 0,3(mol)\\ n_H = 2n_{H_2O} = 0,4(mol)\\ Ta có : \dfrac{n}{2n+2-2k} = \dfrac{0,3}{0,4}\\ \Leftrightarrow 0,4n = 0,6n + 0,6 - 0.6k\\ \Leftrightarrow 0,6k -0,2n = 0,6\\ \Leftrightarrow 6k - 2n = 6\)
Với k = 1 thì n = 0(loại)
Với k = 2 thì n = 3(chọn)
Với k = 3 thì n = 6(chọn)
.....
Vậy hidrocacbon có thể là : \(C_3H_4 ; C_6H_8,...\)
\(Coi\ n_B = 1(mol)\\ \Rightarrow n_{CO_2} = 1.30\% = 0,3(mol) ; n_{H_2O} = 20\% = 0,2(mol) ; n_{O_2} = 50% = 0,5(mol)\)
Vì \(n_{CO_2} > n_{H_2O} \Rightarrow A: C_nH_{2n-2}\)
\(n_A = n_{CO_2} - n_{H_2O} = 0,3 - 0,2 = 0,1(mol)\\ \Rightarrow n = \dfrac{n_{CO_2}}{n_A} = \dfrac{0,2}{0,1} = 2\\ CTPT\ A: C_2H_2\)

\(n_{H_2O} = \dfrac{9}{18} = 0,5(mol)\\ n_{CO_2} = \dfrac{8,96}{22,4} = 0,4(mol)\\ \Rightarrow n_X = n_{H_2O} - n_{CO_2}= 0,5 - 0,4 = 0,1(mol)\\ X\ :\ C_nH_{2n+2}(n \geq 1)\\ n = \dfrac{n_{CO_2}}{n_X} = \dfrac{0,4}{0,1} = 4\\ \Rightarrow CTPT\ X\ : C_4H_{10}\)
CTCT :
\(CH_3-CH_2-CH_2-CH_3 : butan\\ CH_3-CH(CH_3)-CH_3 : 2-metylpropan\)
