Cho 1 ít bột Al vào 150ml dd H2SO4. Phản ứng xong thu được 8,96(l) khí H2 (ở đktc). a/ Viết phương trình phản ứng. b/ Tính khối lượng Al tham gia phản ứng. c/Tính nồng độ mol/lit của dd H2SO4 đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Fe+2HCl->FeCl2+H2
0,3----0,6--0,3------0,3
n H2=0,3 mol
=>m Fe=0,3.56=16.8g
=>CM=0,6\0,1=6M
CuO+H2-tO>Cu+H2O
0.3---------------0,3
=>m Cu=0,3.64=19,2g

a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
b)
$n_{H_2SO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{H_2SO_4}} = \dfrac{0,15}{0,05} = 3M$
c)
$n_{FeSO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{FeSO_4}} = \dfrac{0,15}{0,05} = 3M$

Theo đề bài ta có : nH2 = 10,08/22,4 = 0,45 (mol)
a) PTHH :
Fe+2HCl−>FeCl2+H2↑
0,45mol->,9mol->0,45mol
b) khối lượng mạt sắt tham gia phản ứng là :
mFe = 0,45.56 = 25,2(g)
c)
nồng độ mol của dd HCl đã dùng là :
CMddHCl = 0,9/0,15 = 6(M)

\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\\ n_{Mg}=n_{H_2SO_4}=n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ a,m_{Mg}=0,15.24=3,6\left(g\right)\\ b,C_{MddH_2SO_4}=\dfrac{0,15}{0,2}=0,75\left(M\right)\)
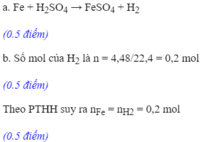

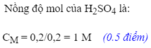
a) 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b) \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
____\(\dfrac{4}{15}\)<----0,4<--------------------0,4
=> \(m_{Al}=\dfrac{4}{15}.27=7,2\left(g\right)\)
c) \(C_{M\left(H_2SO_4\right)}=\dfrac{0,4}{0,15}=2,667M\)