cho m gam fe vào dung dịch hno3 loãng. sau khi phản ứng xảy ra hoàn toàn thu được 3.136l NO (sản phẩm khử duy nhất ở đktc) và dd X gồm 2 muối trong đó khối lượng fe(no3)3 là 2.7m g . tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1/Bt(e); 3*nFe pư HNO3 = 3*nNO
- > nFe(3+) = 0,12 mol.
Fe +--- 2Fe(3+) -> 3Fe(2+)
0,03------0,06 mol.
nFe(3+) sau pư = 0,12 – 0,06 = 0,06 mol
2/nFeSO4 = 0,1 mol
BTE => 0,1 = 2x
=> nCl2 = 0,05 mol
m(muối) = mFeSO4 + mCl2 = 0,1.152 + 0,05.71 = 18,75 gam

Coi hh X gồm Fe, Cu và O
Đặt \(n_{Fe\left(Fe_xO_y\right)}=a;n_{Cu}=b;n_{O\left(Fe_xO_y\right)}=c\) ( mol )
\(\Rightarrow m_{hh}=56a+64b+16c=14,64\left(g\right)\) (1)
\(m_{muối}=m_{Fe\left(NO_3\right)_3}+m_{Cu\left(NO_3\right)_2}=242a+188b=47,58\left(g\right)\) (2)
Bảo toàn e: \(3n_{Fe}+2n_{Cu}=2n_O+3n_{NO}=3a+2b=2c+3.0,09\) (3)
\(\left(1\right);\left(2\right);\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,15\\b=0,06\\c=0,15\end{matrix}\right.\)
\(\%m_{Cu}=\dfrac{0,06.64}{14,64}.100=26,22\%\)
\(\dfrac{x}{y}=\dfrac{0,15}{0,15}=\dfrac{1}{1}\Rightarrow CTHH:FeO\)

Đáp án B
Quy đổi hỗn hợp về Fe và O. Đặt nFe = a và nO = b
+ Vì HNO3 dư và nFe(NO3)3 = 0,4 mol ⇒ nFe = a = 0,4 mol
+ Áp dụng bảo toàn e ta có: 3nFe = 2nO + 3nNO
⇒ nO = 0,3 mol ⇒ m = 0,4×56 + 0,3×16 = 27,2 gam

Đáp án : D
3Cu + 8H+ + 2NO3- -> 3Cu2+ + 2NO + 4H2O
Cu + 2Fe3+ -> Cu2+ + 2Fe2+
Dựa vào 2 phản ứng trên
=> Dung dịch sau phản ứng có : 0,06 mol Fe2+ ; 0,21 mol Cu2+ ; 0,06 mol NO3- ; 0,24 mol SO42-
=> mmuối = 43,56g

Đáp án A
Sơ đồ 1:
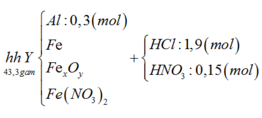
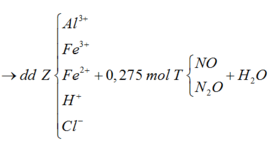
Sơ đồ 2:
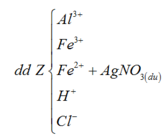
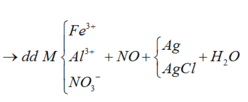
Từ sơ đồ 2 ta có:
BTNT Cl à số mol AgCl = 1,9 (mol) à Số mol Ag = 0,075 (mol)
Số mol H+ dư trong Z = 4nNO = 0,1 (mol)
Bảo toàn e ta có số mol Fe2+ (trong Z) = 3nNO + nAg = 0,15 (mol)
Bảo toàn điện tích cho dung dịch Z ta có: Số mol Fe3+ = 0,2 (mol)
Từ sơ đồ 1 ta có:
Số mol H2O = 1 , 9 + 0 , 15 - 0 , 1 2 = 0 , 975 ( m o l )
BTKL ta có: mkhí T = 9,3 (gam) à n N O + n H 2 O = 0 , 275 30 n N O + 44 n N 2 O = 9 , 3 → n N O = 0 , 2 n N 2 O = 0 , 075
BTNT (N) ta có số mol Fe(NO3)2 = 0 , 2 + 0 , 075 . 2 - 0 , 15 2 = 0 , 1 ( m o l )
à %m(Fe(NO3)2 = 180 . 0 , 1 43 , 3 . 100 % = 41 , 57 %
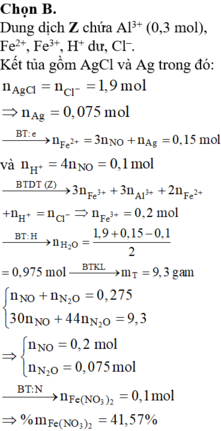

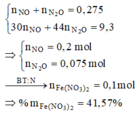
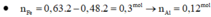
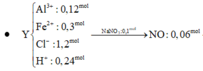
\(n_{NO} = \dfrac{3,136}{22,4}= 0,14\ mol\ ;\ n_{Fe(NO_3)_3} = \dfrac{2,7m}{242} (mol)\\ \Rightarrow n_{Fe(NO_3)_2} = \dfrac{m}{56} - \dfrac{2,57m}{242}(mol)\\ BT\ e\ : 2(\dfrac{m}{56} - \dfrac{2,7m}{242}) + 3.\dfrac{2,7m}{242} = 0,14.3\\ \Rightarrow m = 8,96\ gam\)