Hoà tan hoàn toàn 7,8g hỗn hợp Mg và Al bằng dung dịch HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng thêm 7,0 gam so với ban đầu. Số mol axit đã tham gia phản ứng là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
m dd tăng = mKL – mH2 => lượng H2 sinh ra
Lập hệ 2 phương trình với ẩn là số mol của Al và Mg:
- Phương trình về khối lượng hỗn hợp
- Phương trình bảo toàn e
m dd tăng = mKL – mH2 => mH2 = mKL – m dd tăng = 7,8 – 7 = 0,8 gam => nH2 = 0,4 mol
Khối lượng hỗn hợp là 7,8 gam => 27nAl + 24nMg = 7,8 (1)
Bảo toàn e: 3nAl + 2nMg = 3nH2 = 0,8 (2)
Giải (1) và (2) thu được nAl = 0,2 mol và nMg = 0,1 mol
=> mAl = 5,4 gam và mMg = 2,4 gam

Cho vào 7,8 g đáng lẽ khối lượng dung dịch sẽ tăng 7,8 gam nhưng chỉ tăng 7g chứng tỏ có 0,8 g chất khí thoát ra đó chính là khối lượng H2
Mg+2HCl\(\rightarrow\)MgCl2+H2
2Al+6HCl\(\rightarrow\)2AlCl3+3H2
\(n_{H_2}=\dfrac{0,8}{2}=0,4mol\)
Gọi số mol Mg là x, số mol Al là y.Ta có hệ phương trình:
24x+27y=7,8
x+1,5y=0,4
Giải ra x=0,1, y=0,2
mAl=27x=0,2.27=5,4 gam
Đáp án B
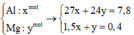
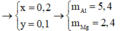
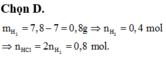

\(Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ m_{tăng} = m_{kim\ loại} - m_{H_2}\\ \Rightarrow n_{H_2} = \dfrac{7,8-7}{2}= 0,4(mol)\\ \Rightarrow n_{HCl} = 2n_{H_2} = 0,4.2 = 0,8(mol)\)