Curcumin là hợp chất hữu cơ có trong củ nghệ. Curcumin có khả năng chống ung thư, chống ôxi hóa, kháng viêm,... Khi đốt cháy hoàn toàn 18,4gam curcumin, sản phẩm sinh ra gồm 23,52lít CO2 (đktc) và 9gam H2O. Tìm công thức phân tử của curcumin, biết khối lượng mol phân tử curcumin là 368gam/mol.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn C.
Tỉ lệ: %C : %H : %O = 5,7067: 5,43 : 1,63 = 3,5 : 3,33 : 1 = 21 : 20 : 6
Vì Sudan I có công thức phân tử trùng với công thức đơn giản nhất Þ C21H20O6

Đáp án A
Dựa vào bản chất phản ứng của X với NaHCO 3 , bảo toàn nguyên tố O; bảo toàn electron trong phản ứng đốt cháy X, ta có :
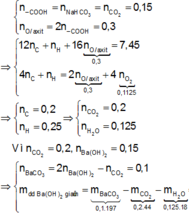
= 8,65 gam

Đáp án B
• X có dạng CxHyOzNt
• nC = nCO2 = 2 mol → x = nC : nX = 2 : 1 = 2
nH = 2 × nH2O = 2 × 63 : 18 = 7 mol → y = nH : nX = 7 : 1 = 7
nN = 2 × nN2 = 2 × 11,2 : 22,4 = 1 mol → t = nN : nX = 1 : 1 = 1 → Vậy X có dạng C2H7OzN. Mà MX = 19,25 × 4 = 77 → z = 2 → X là C2H7O2N
• X + NaOH → khí Y, đốt cháy khí Y → CO2 (làm đục nước vôi trong)
→ Y là chất hữu cơ có chứa C → X là muối của amin HCOONH3CH3
HCOONH3CH3 + NaOH → HCOONa + CH3NH2 (Y) + H2O

Số mol CO2 là 0,18; số mol nước là 0,33.
Ta có: (ncacbonic - nnước) = (\(\overline{k}\) - 1).nhỗn hợp ancol.
Suy ra, số mol hỗn hợp ancol là 0,15.
Số \(\overline{C}\) của hỗn hợp ancol là 0,18/0,15 = 1,2. Suy ra, có một ancol có 1C, ancol còn lại có 2C.
Vậy hai ancol cần tìm là CH3OH và C2H5OH.
\(n_{CO_2}=\dfrac{23,52}{22,4}=1,05\left(mol\right)\)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\)
Bảo toàn C: nC = 1,05(mol)
Bảo toàn H: nH = 1(mol)
=> \(n_O=\dfrac{18,4-1,05.12-1.1}{16}=0,3\left(mol\right)\)
=> nC : nH : nO = 1,05 : 1 : 0,3 = 21:20: 6
=> CTPT: (C21H20O6)n
Mà M = 368 g/mol
=> n = 1
=> CTPT: C21H20O6