Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(V_{C_2H_6}=13,44-6,72=6,72\left(l\right)\)
=> \(n_{C_2H_6}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{C_2Ag_2}=\dfrac{24}{240}=0,1\left(mol\right)\)
=> \(n_{C_2H_2}=0,1\left(mol\right)\)
=> \(n_{C_2H_4}=\dfrac{13,44}{22,4}-0,3-0,1=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}\%m_{C_2H_6}=\dfrac{0,3.30}{0,3.30+0,2.28+0,1.26}.100\%=52,326\%\\\%m_{C_2H_4}=\dfrac{0,2.28}{0,3.30+0,2.28+0,1.26}.100\%=32,558\%\\\%m_{C_2H_2}=\dfrac{0,1.26}{0,3.30+0,2.28+0,1.26}.100\%=15,116\%\end{matrix}\right.\)

ĐÁP ÁN B
Chỉ có C2H2 phản ứng tạo Ag2C2 => nkhí = nC2H4 = 0,13 mol
,nAg2C2 = nC2H2 = 0,12 mol
=> %mC2H2 = 46,15%

$C_2H_2 + 2AgNO_3 + 2NH_3 \to Ag_2C_2 + 2NH_4NO_3$
Theo PTHH :
n C2H2 = n Ag2C2 = 48/240 = 0,2(mol)
$C_2H_4 + Br_2 \to C_2H_4Br_2$
$C_2H_2 + 2Br_2 \to C_2H_2Br_4$
n Br2 = 2n C2H2 + n C2H4 = 80/160 = 0,5(mol)
=> n C2H4 = 0,5 - 0,2.2 = 0,1(mol)
Vậy :
%V C2H2 = 0,2.22,4/8,96 .100% = 50%
%V C2H4 = 0,1.22,4/8,96 .100% = 25%
%V CH4 = 100% -50% - 25% = 25%

Đáp án C
C2H2 và C2H4 cho qua dd AgNO3 chỉ có C2H2 phản ứng => khí đi ra là khí C2H4
BTNT C: nC2H2 = nAg2C2 = 28,8: 240 = 0,12 (mol)
nC2H4 = 2,912 : 22,4 = 0,13 (mol)
%m C2H2 = (mC2H2 : mhh khí).100% = [ 0,12. 26 : (0,12.26 + 0,13.28)].100% = 46,15%

Chọn D
C2H2 + AgNO3 -> Ag2C2↓
=> nkết tủa = nC2H2 =0,04 mol
,mbình tăng = mC2H2 + mC2H4 = 2,72g => nC2H4 = 0,06 mol
Đốt cháy : nCO2 = 2nC2H2 + 2nC2H4 = 0,2 mol
nOH = 0,15 mol < nCO2
=> phản ứng chỉ tạo HCO3 với số mol là 0,15 mol

Đáp án A
nC2H2=x => nAg2C2=x
nCH3CHO=y => nAg = 2y
+ x+y=11,2/22,4=0,5 (1)
+ 240x+108.2y=112,8 (2)
(1) và (2) => x=0,2; y=0,3
nBr2=2nC2H2+nCH3CHO=2.0,2+0,3=0,7 mol => mBr2=0,7.160=112 gam
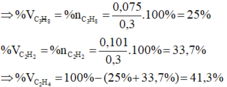
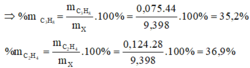
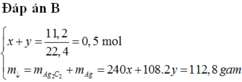
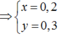
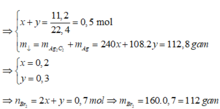
nhh = 5.6/22.4 = 0.25(mol)
nAg2C2 = nC2H2 = 24/240 = 0.1 (mol)
nBr2 = 0.3 (mol)
=> nC2H4 = 0.3 - 0.1*2 = 0.1 (mol)
nCH4 = 0.25 - 0.1 - 0.1 = 0.05 (mol)
mCH4 = 0.05*16 = 0.8 (g)
mC2H2 = 0.1*26 = 2.6 (g)
mC2H4 = 0.1*28 = 2.8 (g)
mhh = 0.8 + 2.6 + 2.8 = 6.2 (g)
%CH4 = 0.8/6.2 * 100% = 12.9%
%C2H4 = 2.8/ 6.2 * 100% = 45.16%
%C2H2 = 41.94%