Tìm công thức hóa học của hợp chất X, trong X chứa 85,71% CO2 và và 14,29% H2, 1 lít khí X ở điều kiện tiêu chuẩn nặng 1,25 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n A=0,75 mol
=>M A=\(\dfrac{21}{0,75}\)=28 g\mol
Gọi CTTQ của hợp chất A là : CxHy
Theo đề bài ta có :
MCxHy = 12x + y
Mà %C = 85,71%
=> MCxHy = 12x : 85,71% = 14x (g/mol)
Và %H = 14,29%
=> MCxHy = y : 14,29% = 7y (g/mol)
=> 14x = 7y
=> 2x = y
=> CxHy là CxH2x
=>ta có 14x=28=>x=2
->CTHH :C2H4

do hỗn hợp thu đc chỉ có CO2 và H2O => ct CxHy mà nCO2=O,5 mol , nH2O=0,5mol,=>đó là anken CnH2n
na=0,25 mol . áp dụng bảo toàn nguyên tố ooxxi t có nO2=(2nCO2+nH2O)/2=0.75mol
bảo toàn khối lượng => mhh=mCO2+mH2O-mO2=7g
=>Mhh=28 =>anken chính là C2H4

Gọi số mol CO2, H2O là a, b
=> 2a = b
\(n_{O_2}=\dfrac{44,8}{22,4}=2\left(mol\right)\)
Theo ĐLBTKL: 44a + 18b = 16 + 2.32 = 80
=> a = 1; b = 2
Bảo toàn C: nC = 1(mol)
Bảo toàn H: nH = 4 (mol)
Xét mC + mH = 1.12 + 4.1 = 16(g)
=> X chỉ chứa C và H
nC : nH = 1 : 4
=> CTPT: CH4

nCO2 = 8.8/44=0.2 mol
nH2O = 3.6/18 = 0.2 mol
mO = 4.4 - 0.2*12 - 0.2*2 = 1.6 (g)
nO = 1.6/16 = 0.1 mol
CT : CxHyOz
x : y : z = 0.2 : 0.4 : 0.1 = 2 : 4 : 1
CT đơn giản : (C2H4O)n
M = 3.93 *22.4 = 88
=> 44n=88
=> n = 2
CT : C4H8O2

a)
n CO2 = 6,6/44 = 0,15(mol) => n C = n CO2 = 0,15(mol)
n H2O = 5,4/18 = 0,3(mol) => n H = 2n H2O = 0,6(mol)
=> n O = (4,8 - 0,15.12 - 0,6)/16 = 0,15(mol)
Ta có :
n C : n H : n O = 0,15: 0,6 : 0,15 = 1 : 4 : 1
=> CTP của A là (CH4O)n
M A = (12 + 4 + 16)n = 3,2/(2,24/22,4) = 32
=> n = 1
Vậy CTPT của A là CH4O
b)
$2CH_3OH + 2Na \to 2CH_3ONa + H_2$
n CH3OH = n CO2 = 0,15(mol)
=> n H2 = 1/2 n CH3OH = 0,075(mol)
=> V H2 = 0,075.22,4 = 1,68(lít)


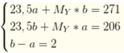
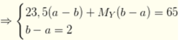
\(n_X=\dfrac{1}{22,4}=\dfrac{5}{112}\left(mol\right)=>M_X=\dfrac{1,25}{\dfrac{5}{112}}=28\left(g/mol\right)\)
\(m_C=\dfrac{85,71.28}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=28-24=4\left(g\right)=>n_H=\dfrac{4}{1}=4\left(mol\right)\)
=> CTHH: C2H4
thank nha