Hòa tan hoàn toàn 32 gam hỗn hợp gồm bột Al và Mg trong lọ đựng dung dịch NaOH dư sau phản ứng thấy có 16,2 gam chất rắn bị hòa tan Tính thành phần phần trăm theo khối lượng của kim loại Mg có trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{cr}=m_{Fe}=12.8\left(g\right)\)
\(NaOH+Al+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\)
\(m_{Al}=m_{hh}-m_{Fe}=18.2-12.8=5.4\left(g\right)\)
\(\%m_{Al}=\dfrac{5.4}{18.2}\cdot100\%=29.67\%\)

\(n_{H_2} = \dfrac{4,35-3,95}{2} = 0,2(mol)\\ Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\)
\(\left\{{}\begin{matrix}Mg:x\left(mol\right)\\Al:y\left(mol\right)\end{matrix}\right.\)→ \(\left\{{}\begin{matrix}24x+27y=4,35\\x+1,5y=0,2\end{matrix}\right.\)→\(\left\{{}\begin{matrix}x=0,125\\y=0,05\end{matrix}\right.\)
Vậy :
\(\%m_{Mg} = \dfrac{0,125.24}{4,35}.100\% = 68,97\%\\ \%m_{Al} = 100\% - 68,97\% = 31,03\%\)

Đáp án C:
Gọi x, y là số mol Mg và Fe trong mỗi phần
=> 24x+56y = 4,32
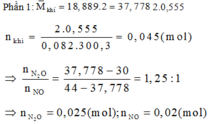

Phần 2: Gọi a, b lần lượt là số mol của AgNO3 và Cu(NO3)2
Sau phản ứng có 3 kim loại là Ag, Cu và Fe dư.
Gọi số mol Fe tham gia phản ứng là t (mol)
Bảo toàn electron ta có: nenhường= ne nhận
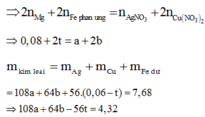
Chỉ có duy nhất Fe dư tan trong HCl
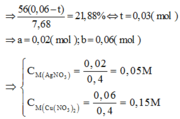

PT: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
a, Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 27y = 12,6 (1)
Ta có: \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+\dfrac{3}{2}n_{Al}=x+\dfrac{3}{2}y\left(mol\right)\)
\(\Rightarrow x+\dfrac{3}{2}y=0,6\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MG}=\dfrac{0,3.24}{12,6}.100\%\approx57,1\%\\\%m_{Al}\approx42,9\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{H_2SO_4}=n_{H_2}=0,6\left(mol\right)\\n_{MgSO_4}=n_{Mg}=0,3\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{H_2SO_4}=0,6.98=58,8\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{58,8}{14,7\%}=400\left(g\right)\)
Ta có: m dd sau pư = 12,6 + 400 - 0,6.2 = 411,4 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgSO_4}=\dfrac{0,3.120}{411,4}.100\%\approx8,75\%\\C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1.342}{411,4}.100\%\approx8,31\%\end{matrix}\right.\)
Bạn tham khảo nhé!

a, PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 24y = 7,8 (1)
Ta có: m dd tăng = mKL - mH2 ⇒ mH2 = 7,8 - 7 = 0,8 (g)
\(\Rightarrow n_{H_2}=\dfrac{0,8}{2}=0,4\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Mg}=\dfrac{3}{2}x+y=0,4\left(mol\right)\left(2\right)\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{7,8}.100\%\approx69,23\%\\\%m_{Mg}\approx30,77\%\end{matrix}\right.\)

1. Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%
nH2=13,44/22,4=0,6(mol)
Đặt: nMg=a(mol); nAl=b(mol) (a,b>0)
1) PTHH: Mg + H2SO4 -> MgSO4 + H2
a__________a________a_____a(mol)
2Al +3 H2SO4 -> Al2(SO4)3 + 3 H2
b___1,5b______0,5b____1,5b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24a+27b=12,6\\a+1,5b=0,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
=> mMg=0,3.24=7,2(g)
=>%mMg= (7,2/12,6).100=57,143%
=>%mAl=42,857%
2) mMgSO4=120.a=120.0,3=36(g)
mAl2(SO4)3=342.0,5b=342.0,5.0,2= 34,2(g)
mH2SO4= (0,3+0,2.1,5).98=58,8(g)
=>mddH2SO4=58,8: 14,7%=400(g)
=>mddsau= 12,6+400 - 2.0,6= 411,4(g)
=>C%ddAl2(SO4)3= (34,2/411,4).100=8,313%
C%ddMgSO4=(36/411,4).100=8,751%
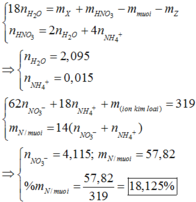

Trong bài trên thì chỉ có Al tác dụng NaOH nhé
\(2Al + 2NaOH + 2H_2O \rightarrow 2NaAlO_2 + 3H_2\)
\(m_{Mg}= m_{hỗn hợp} - m_{Al} = 32 - 16,2 =15,8 g\)
%mMg=\(\dfrac{15,8}{32} . 100\)%=49,375%