hòa tan hỗn hợp bột fe và feo trong dung dịch h2so4 loãng , sau đó làm bay hơi dung dịch thu đc 111,2 g feso4. 7h2o .tính thành phần % khối lượng các chất trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi x, y lần lượt là số mol của Fe, FeO
nFeSO4.7H2O=111,2/278=0,4(mol)
Fe+H2SO4\(\rightarrow\)FeSO4+H2
x.......................x
FeO+H2SO4\(\rightarrow\)FeSO4+H2O
y.............................y
Ta có: nFeSO4=nFeSO4.7H2O=0,4(mol)
\(\Rightarrow\left\{{}\begin{matrix}x+y=0,4\\56x+72y=27,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,3\end{matrix}\right.\)
%mFe=\(\dfrac{0,1.56}{27,2}.100=20,59\%\)
%mFeO=79,41%
Chúc bạn học tốt!

\(m_{cr}=m_{Fe}=12.8\left(g\right)\)
\(NaOH+Al+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\)
\(m_{Al}=m_{hh}-m_{Fe}=18.2-12.8=5.4\left(g\right)\)
\(\%m_{Al}=\dfrac{5.4}{18.2}\cdot100\%=29.67\%\)

a) Y là Cu
$m_{Cu} = 8(gam)$
Gọi $n_{Al} = a(mol) ; n_{Fe} = b(mol)$
Ta có : $27a + 56b + 8 = 13,45(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(2)$
Từ (1)(2) suy ra a = 0,15 ; b = 0,025$
$\%m_{Cu} = \dfrac{8}{13,45}.100\% = 59,47\%$
$\%m_{Al} = \dfrac{0,15.27}{13,45}.100\% = 30,11\%$
$\%m_{Fe} = 10,42\%$
b)
$n_{H_2SO_4} = n_{H_2} = 0,25(mol)$
$V_{dd\ H_2SO_4} = \dfrac{0,25}{0,5} = 0,5(lít)$

\(a) \\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O\\ b) \text{Theo PTHH} : \\ n_{Fe} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ \%m_{Fe} = \dfrac{0,1.56}{8} .100\% = 70\%\\ \%m_{Fe_2O_3} = 100\% -70\% = 30\%\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ \left(mol\right).....0,1...........................\leftarrow0,1\\ m_{Fe}=0,1.56=5,6\left(g\right)\\ m_{Fe_2O_3}=\Sigma m_{hh}-m_{Fe}=8-5,6=2,4\left(g\right)\\ PTHH:Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ \left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{8}.100\%=70\%\\\%m_{Fe_2O_3}=\dfrac{2,4}{8}.100\%=30\%\end{matrix}\right.\)

Đặt nZn = x mol; nFe = y mol.
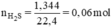
Ta có hệ phương trình: 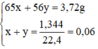
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Gọi a, b lần lượt là số mol của NaI và NaBr ban đầu, ta có : Sơ đồ phản ứng:
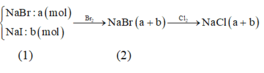

Đáp án A

a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$FeO + H_2SO_4 \to FeSO_4 + H_2O$
$FeSO_4 + 7H_2O \to FeSO_4.7H_2O$
b)
n Fe = a(mol) ; n FeO = b(mol)
=> 56a + 72b = 54,4(1)
Theo PTHH :
n FeSO4.7H2O = a + b = 222,4/278 = 0,8(2)
Từ (1)(2) suy ra a = 0,2 ; b = 0,6
Suy ra :
%m Fe = 0,2.56/54,4 .100% = 20,59%
%m FeO = 100% -20,59% = 79,41%
Đề thiếu rồi em ơi.