Nung nóng 237 gam thuốc tím chứa 80% kali pemanganat(KMnO4), thì thu được khí O2. Lấy 75% lượng oxy thu được đi oxy hóa vừa đủ 11,16 gam đơn chất R (chưa biết hóa trị). Xác định đơn chất R (biết R là đơn chất dạn rắn)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nCu = 48/64 = 0.75 (mol)
2R + 6HCl => 2RCl3 + 3H2
0.5__1.5_______0.5____0.75
MR = 13.5/0.5 = 27
R là : Al
VH2 = 0.75 * 22.4 = 16.8 (l)
mAlCl3 = 0.5*133.5 = 66.75 (g)
mHCl = 1.5*36.5 = 54.75 (g)
cho mình hỏi dữ liệt này thế nào ạ
Dẫn toàn bộ khí sinh ra đi qua bột CuO vừa đủ nung nóng thì được 48g chất rắn

\(n_{KMnO_4}=\dfrac{63,2}{158}=0,4\left(mol\right)\\
pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,4 0,2
=> \(V_{O_2\left(lt\right)}=0,2.22,4=4,48\left(l\right)\\
V_{O_2\left(tt\right)}=\dfrac{90.4,48}{100}=4,032\left(l\right)\)

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
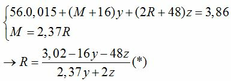
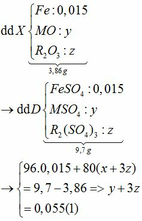
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

Chọn đáp án A
BTNT.H Þ nH trong M = 0,26x2 = 0,52
Đặt ancol T là R'(OH)n Þ nT = 0,035x2/n = 0,07/n và mT = 2,17 + 0,035x2 = 2,24
Þ MT = R' + 17n = 2,24/(0,07/n) = 32n Þ n = 1 và R' = 15 phù hợp Þ T là CH3OH (0,07 mol)
Đề bài không nói este mạch hở Þ Khả năng cao có este của phenol
Đặt nNaOH phản ứng = a Þ nH2O (từ phenol) = (a - 0,07)/2 = 0,5a - 0,035 = nEste phenol
BTNT.Na Þ nNa2CO3 = 0,5a; BTNT.C Þ nC trong M = 0,415 + 0,5a + 0,07 = 0,485 + 0,5anO trong M = 2nX + 2nY = 0,07x2 + 2x(0,5a - 0,035) = a + 0,07Þ 10,32 = 12x(0,485 + 0,5a) + 0,52 + 16x(a + 0,07) Þ a = 0,13 Þ Đúng thật là có este phenol
Chọn X là este của ancol thường, Y là este có gốc phenol Þ Cx> 2, CY > 7
Biện luận nghiệm nguyên: 0,07CX + 0,03CY = 0,485 + 0,5x0,13 + 0,07 Þ CX = 4, CY = 9
Biện luận nghiệm nguyên: 0,07HX + 0,03HY = 0,26x2 Þ HX = 4, HY = 8
Þ Công thức các este là: HCºC-COOCH3 (0,07) và H2C=CH-COOC6H5 (0,03)
Þ mC2H3COONa = 0,03x94 = 2,82.

Theo định luật bảo toàn khối lượng ta có: m O 2 = 15,8 – 12,6 = 3,2(g)
Hiệu suất của phản ứng phân hủy: H = 2,8/3,2 x 100 = 87,5%

a) \(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
b) Đặt x là số mol của \(KMnO_4\)
\(\Rightarrow n_{K_2MnO_4}=\frac{1}{2}n_{KMnO_4}=\frac{1}{2}x\)
Ta có : \(m_{KMnO_4}-m_{K_2MnO_4}=2,4\left(g\right)\)
\(\Leftrightarrow158x-\frac{197}{2}x=2,4\)
\(\Leftrightarrow x\approx0,04\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,04\times158=6,32\left(g\right)\)

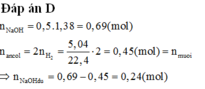
NaOH dư sẽ tham gia phản ứng vôi tôi xút.
Ta có phương trình: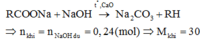
Khí là C2H6 Muối là C2H5COONa
mmuối = 96.0,45=43,2(g)
Bảo toàn khối lượng ta có:
meste + mNaOH = mmuối + mNaOHdư + mancol
mmuối = 96.0,45 = 43,2gam (muối là C2H5COONa)
PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Ta có: \(m_{KMnO_4}=237.80\%=189,6\left(g\right)\)
\(\Rightarrow n_{KMnO_4}=\dfrac{189,6}{158}=1,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=0,6\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dadung\right)}=0,6.75\%=0,45\left(mol\right)\)
Giả sử R có hóa trị n.
PT: \(4R+nO_2\underrightarrow{t^o}2R_2O_n\)
Theo PT: \(n_R=\dfrac{4}{n}n_{O_2}=\dfrac{1,8}{n}\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{11,16}{\dfrac{1,8}{n}}=6,2n\left(g/mol\right)\)
Với n = 1 ⇒ MR = 6,2 (loại)
Với n = 2 ⇒ MR = 12,4 (loại)
Với n = 3 ⇒ MR = 18,6 (loại)
Với n = 4 ⇒ MR = 24,8 (loại)
Với n = 5 ⇒ MR = 31 (nhận)
Vậy: R là photpho (P).
Bạn tham khảo nhé!