Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp ánA
Gọi x, y, z lần lượt là số mol của C2H2, C2H6, C3H6 trong 24,8 gam X. Ta có:

x + y + z mol hỗn hợp X tác dụng được với 2x + z mol Br2
0,5 mol hỗn hợp X tác dụng được với 0,645 mol Br2
Suy ra 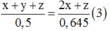
Từ (1),(2),(3) suy ra:
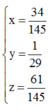
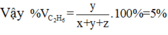
Đáp án A

Đáp án D
Đốt cháy X thu được 1,6 mol H2O vậy X chứa 3,2 mol H.
→ n C ( X ) = 1 , 8 m o l
Gọi số mol C2H2, C2H6, C3H6 lần lượt là a, b, c
=> 2a+2b+3c= 1,8; 2a+6b+6c=3,2
Mặt khác, 0,5 mol X tác dụng vừa đủ 0,645 mol Br2
→ 2 a + 1 c a + b + c = 0 , 645 0 , 5
Giải hệ: a = 34 145 ; b = 5 145 ; c = 61 145
Vậy %etan= 5%.

Đáp án D
Đốt cháy X thu được 1,6 mol H2O vậy X chứa 3,2 mol H.
→ n C ( X ) = 1 , 8 m o l
Gọi số mol C2H2, C2H6, C3H6 lần lượt là a, b, c
=> 2a + 2b + 3c = 1,8; 2a +6b + 6c = 3,2
Mặt khác, 0,5 mol X tác dụng vừa đủ 0,645 mol Br2
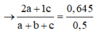
Giải hệ:
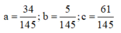
Vậy %etan=5%.

Đáp án D
Đốt cháy X thu được 1,6 mol H2O vậy X chứa 3,2 mol H.
→ n C ( X ) = 1 , 8 m o l
Gọi số mol C2H2, C2H6, C3H6 lần lượt là a, b, c
=> 2a + 2b + 3c = 1,8; 2a + 6b + 6c = 3,2;
Mặt khác, 0,5 mol X tác dụng vừa đủ 0,645 mol Br2
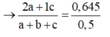
Giải hệ:

Vậy %etan=5%.

Đáp án C
Hỗn hợp X theo đề bài là một hỗn hợp đồng nhất, tỷ lệ giữa các thành phần khí trong hỗn hợp là không đổi. Do đó, khối lượng phân tử trung bình M của hỗn hợp là một giá trị không đổi.
Giả sử có 1 mol hỗn hợp X.
Gọi x, y, z lần lượt là số mol của ba khí trong 1 mol hỗn hợp X. Từ giả thiết, ta có hệ phương trình:
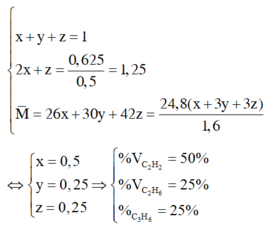



Gọi : \(\left\{{}\begin{matrix}n_{C_2H_2}=a\left(mol\right)\\n_{C_2H_6}=b\left(mol\right)\\n_{C_3H_6}=c\left(mol\right)\end{matrix}\right.\)⇒ 26a + 30b + 42c = 24,8(1)
BTNT với H :
\(n_{H_2O} = a + 3b + 3c = \dfrac{28,8}{18} = 1,6(2)\)
Mặt khác, 0,5 mol X phản ứng vừa đủ với \(\dfrac{500.20\%}{160} = 0,625\) mol Brom.
Ta có :
\(\dfrac{n_X}{n_{Br_2}} = \dfrac{a+ b+ c}{2a + c} = \dfrac{0,5}{0,625}\)⇔0,375a -0,625b -0,125c = 0(3)
Từ (1)(2)(3) suy ra a = 0,4 ; b = 0,2 ; c = 0,2
Vậy :
\(\%V_{C_2H_2} = \dfrac{0,4}{0,4+0,2+0,2}.100\% = 50\%\\ \%V_{C_2H_6} = \%V_{C_3H_6} = \dfrac{0,2}{0,4+0,2+0,2}.100\% = 25\%\)