tính khối lượng quặng pirit sắt chứa 90% FeS2 còn lại là tạp chất trơ cần dùng để sản xuất 5000 tấn Fe . giả sử hiệu suất phản ứng đạt 89,6%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


K/lượng của Fe2O3 nguyên chất trong 250 tấn quặng hematit là :
250.60%=150(tấn)
=150000000(g)
Fe2O3+3CO-->2Fe+3CO2
Số mol của Fe2O3 là:
n=m/M=150000000:160
=937500(mol)
Số mol của Fe là:
nFe=2nFe2O3=2.937500
=1875000(mol)
K/lượng của Fe là:
m=n.M=1875000.56
=105000000(g)
K/lượng của Fe nếu hiệu suất chỉ đạt 90% là:
105000000.90%
=94500000(g)
=94,5 tấn
Mình không biết là đúng hay sai nha
Cảm ơn bạn nka! Nhưng tiếc là mình đã hoàn thành bài này xong rồi.

a) 4 FeS2 + 11 O2 -to-> 2 Fe2O3 + 8 SO2
SO2+ 1/2 O2 -to,xt-> SO3
SO3+ H2O -> H2SO4
mFeS2= 0,58. 3=1,74(tấn)
m(H2SO4, lí thuyết)=(98.1,74)/480=0,35525(tấn)
Vì: H=70% -> mH2SO4(TT)=0,35525.70%=0,248675(tấn)
=> mddH2SO4= (0,248675.100)/98=0,25375(tấn)=253,75(kg)

Đáp án A
Để đơn giản về tính toán thì ta xem đơn vị tấn như gam.

Quặng này chứa 10% tạp chất trơ tức
FeS2 chiếm 90%.
Vậy khối lượng quặng pirit sắt cần:
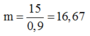

Đáp án A
Để đơn giản về tính toán thì ta xem đơn vị tấn như gam.


Fe + S (0,04 mol) \(\underrightarrow{t^o}\) FeS (0,04 mol).
Số mol sắt (II) sunfua cần sản xuất là 3,52/88=0,04 (mol).
Khối lượng lưu huỳnh cần dùng trên lý thuyết là 0,04.32=1,28 (g).
Khối lượng quặng lưu huỳnh thực tế cần dùng là 1,28:90%:90%=128/81 (g).

mtạp chất=120.10%=12(tấn)
mFeS2=120-12=108(tấn)
mFe lý thuyết=\(\dfrac{108}{120}.56=50,4\left(tấn\right)\)
H=\(\dfrac{48}{50,4}.100\%=95,238\%\)

Quặng Pirit (FeS2)---------> SO2
Bảo toàn nguyên tố S: \(n_{FeS_2}.2=n_{SO_2}.1=\dfrac{50000}{22,4}=\dfrac{15625}{7}\Rightarrow n_{FeS_2}=\dfrac{15625}{14}\)(mol)
Vì H=95% => \(n_{FeS_2}=\dfrac{15625}{14}.\dfrac{100}{95}=1174,81\left(mol\right)\)
=> \(m_{FeS_2}=1174,81.120=140977,2\left(kg\right)\)
Vì quặng pirit chứa 98% FeS2
=> \(m_{quặng}=140977,2.\dfrac{100}{98}=143854,3\left(kg\right)\approx143,85\left(tấn\right)\)
\(n_{Fe} = \dfrac{5000.1000}{56} = \dfrac{625000}{7}\ kmol\\ n_{FeS_2\ đã\ dùng} = \dfrac{n_{Fe}}{H\%} = \dfrac{\dfrac{625000}{7}}{89,6\%} = 99649,23\ kmol\\ m_{quăng\ pirit} = \dfrac{m_{FeS_2}}{90\%} = \dfrac{99649,23.120}{90\%} = 13259897,33 (kg) = 13259,89(tấn)\)
\(n_{Fe}=\dfrac{5000\cdot10^6}{56}=\dfrac{625}{7}\cdot10^6\left(mol\right)\)
\(BTFe:\)
\(n_{FeS_2}=n_{Fe}=\dfrac{625}{7}\cdot10^6\left(mol\right)\)
\(n_{FeS_2\left(tt\right)}=\dfrac{\dfrac{625}{7}\cdot10^6}{89.6}=\dfrac{56000\cdot10^6}{7}\left(mol\right)\)
\(\Rightarrow m_{FeS_2}=\dfrac{56000\cdot10^6\cdot120}{7}=960000\cdot10^6\left(g\right)=960000\left(tấn\right)\)
\(m_{quặng}=\dfrac{960000\cdot100}{90}=1066666.67\left(tấn\right)\)