Oxit của một nguyên tố ở 2 mức hóa trị chứa 50% và 60% khối lượng oxi. Tìm nguyên tử khối và viết công thức hóa học của 2 oxit trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Công thức hóa học của oxit cần tìm là MO.
Khối lượng mol của MO = M + 16
Và trong 100g MO có 20g oxi.
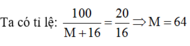
Vậy M là kim loại Cu, công thức hóa học của oxit là CuO.

Gọi công thức tổng quát là $XH_4$
\(\%H=25\%\\ \Rightarrow \dfrac{4}{X+4}.100\%=25\%\\ \Rightarrow X=12\\ Tên:\ Cacbon\\ CTHH:\ CH_4\)

1.\(\dfrac{m_{Al}}{m_O}=\dfrac{9}{8}\)
\(Al_xO_y\)
\(x:y=\dfrac{9}{27}:\dfrac{8}{16}=\dfrac{1}{3}:\dfrac{1}{2}=2:3\)
Vậy CTHH là \(Al_2O_3\)
2.\(\rightarrow\%S=100-60=40\%\)
\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
Vậy CTHH là \(SO_3\)
3.
a.b.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_{H_2SO_4}=2.0,2=0,4mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 < 0,4 ( mol )
0,2 0,2 0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Chất dư là H2SO4
\(m_{H_2SO_4\left(dư\right)}=\left(0,4-0,2\right).98=19,6g\)
c.Nồng độ gì bạn nhỉ?

a)
Do R có hóa trị III trong hợp chất với hidro
=> R có hóa trị V trong oxit cao nhất
Oxit cao nhất của R là: R2O5
b) Có \(\%O=\dfrac{16.5}{2.M_R+16.5}.100\%=74,074\%\)
=> MR = 14
=> R là N(Nitơ)

+) Oxit chứa 50% khối lượng oxi :
Gọi công thức hóa học của oxit là \(M_xO_y\) (x,y nguyên dương tối giản)
Ta có : \(\frac{16y}{M_M\cdot x+16y}\cdot100\%=50\%\)
=> \(32y=M_M\cdot x+16y\)
=> \(M_M=8\cdot\frac{2y}{x}\)
Ta có bảng sau :
=> oxit cần tìm là SO2
=> \(M_{SO_2}=32+16\cdot2=64\) (g/mol)
+) Oxit chứa 60% khối lượng oxi :
Gọi công thức của oxit chứa 60% khối lượng oxi là \(M_aO_b\) (a,b nguyên dương tối giản)
Ta có : \(\frac{16b}{M_M\cdot a+16b}\cdot100\%=60\%\)
=> \(16b=0,6M_M\cdot a+9,6b\)
=> \(M_M=\frac{16}{3}\cdot\frac{2y}{x}\)
Ta có bảng sau :
=> oxit cần tìm là SO3
=> \(M_{SO_3}=32+16\cdot3=80\)(g/mol)
Postscript : khi tìm đc ngto là lưu huỳnh, có thể lắp xuống dưới để tìm cthh của oxit còn lại, có vẻ như thế sẽ dễ hơn