Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
TH 1: Cả hai muối NaX và NaY đều cho kết tủa khi pư với AgNO3
NaZ + AgNO3 → NaNO3 + AgZ↓
a a
Áp dụng pp tăng giảm khối lượng ![]()
→ a = 0,03 (mol) → MNaZ= 201→ Z = 178
X và Y là I (127) và At (210), nhưng At không có tự nhiên nên TH này loại
TH 2: Chỉ có 1 muối tạo kết tủa nghĩa là hai muối này là NaF và NaCl
nAgCl = 8,61/143,5 = 0,06 mol
NaCl + AgNO3 → NaNO3 + AgCl↓
0,06 0,06
mY = mNaCl = 0,06.58,5 = 3,51g
mX = mNaF = 6,03 - 3,51 = 2,52g
%NaF = ![]() .100% = 41,8%
.100% = 41,8%

Chọn đáp án D
Gỉa sử X không phải Flo
Gọi CTTB của X và Y là X ¯
N a X - + A g N O 3 → A g X - + N a N O 3
23 + X ¯ → 108 + X ¯ (g)
6,03 → 8,61 (g)
8,61.(23 + X ¯ ) = 6,03. (108 + X ¯ )
X ¯ = 175,3 (loại)
X là Flo, Y là Clo
Kết tủa chỉ gồm AgCl; n A g C l = n N a C l = 8,61 : 143,5 = 0,06 mol
% m N a C l = 0 , 06 . 58 , 5 6 , 03 . 100 = 58,2 (%) → % m N a F = 41,8 (%).

Quy NaX và NaY về NaR
\(n_{AgNO_3}=0,15.0,2=0,05\left(mol\right)\)
PTHH: \(AgNO_3+NaR\rightarrow AgR\downarrow+NaNO_3\)
0,05------>0,05
\(\rightarrow M_R=\dfrac{2,2}{0,05}=44\left(g\text{/}mol\right)\)
Mà X và Y là 2 nguyên tố halogen thuộc 2 chu kì liên tiếp
\(\rightarrow M_X< M_R< M_Y\rightarrow M_X< 44< M_Y\)
---> X và Y là Cl và Br

TH1: NaX là NaF => NaY là NaCl
Do NaF không tác dụng với AgNO3 nên chỉ có NaCl phản ứng.
Ta có phương trình: NaCl + AgNO3 ===> NaNO3 + AgCl
nAgCl= 0,06(mol)= nNaCl => mNaCl= 3,51(g) => %mNaCl=58,2%=>%mNaF=41,8%
TH2: NaX không phải là NaF.
Gọi công thức chung của 2 muối cần tìm là NaB
Ta có phương trình: NaB+AgNO3==>NaNO3+AgB
nNaB= nAgB=0,06 mol ==> \(\dfrac{6,03}{23+M_B}\) = \(\dfrac{8,61}{108+M_B}\) ==> MB= 175,6
Vậy 2 muối là Iot và Atatin nhưng do Atatin không có trong tự nhiên nên loại.

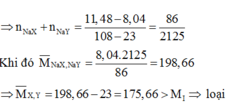

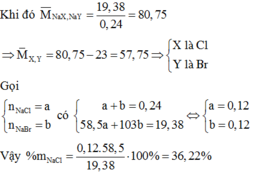

a)
Gọi CTHH của hai muối là NaR
\(NaR +AgNO_3 \to AgR + NaNO_3\)
Ta có:
\(n_{NaR} = n_{AgNO_3} = 0,2.0,1 = 0,02(mol)\\ \Rightarrow 23 + R = \dfrac{1,615}{0,02} = 80,75\\ \Rightarrow R = 57,75\)
Vì MCl = 35,5 < R = 57,75 <MBr = 80 nên 2 muối là NaCl và NaBr
b)
\(\left\{{}\begin{matrix}NaCl:x\left(mol\right)\\NaBr:y\left(mol\right)\end{matrix}\right.\)→ \(\left\{{}\begin{matrix}58,5x+103y=1,615\\x+y=0,02\end{matrix}\right.\)→\(\left\{{}\begin{matrix}x=0,01\\y=0,01\end{matrix}\right.\)
Vậy :
\(\%m_{NaCl} = \dfrac{0,01.58,5}{1,615}.100\% = 36,22\%\\ \%m_{NaBr} = 100\% - 36,22\% = 63,78\%\)
c)
\(\left\{{}\begin{matrix}AgCl:x=0,01\left(mol\right)\\AgBr:y=0,01\left(mol\right)\end{matrix}\right.\)→ mkết tủa = 0,01.143,5 + 0,01.188=3,315(gam)
\(n_{AgNO_3}=0.2\cdot0.1=0.02\left(mol\right)\)
\(TH1:X:F\\ Y:Cl\)
\(NaCl+AgNO_3\rightarrow NâNO_3+AgCl\)
\(0.02........0.02............0.02..........0.02\)
\(m_{NaCl}=0.02\cdot58.5=1.17\left(g\right)< 1.615\left(g\right)\)
\(\%NaCl=\dfrac{1.17}{1.615}\cdot100\%=72.45\%\)
\(\%NaF=100-72.45=27.55\%\)
\(m_{AgCl}=0.02\cdot143.5=2.87\left(g\right)\)
\(TH2:Đặt:NaZ\)
\(NaZ+AgNO_3\rightarrow NaNO_3+AgZ\)
\(0.02.........0.02\)
\(M_{NaZ}=\dfrac{1.615}{0.02}=80.75\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow23+Z=80.75\\ \Rightarrow Z=57.75\)
\(X< Z< Y\Rightarrow X:Cl,Y:Br\)
\(Đặt:n_{NaCl}=a\left(mol\right),n_{NaBr}=b\left(mol\right)\)
\(\left\{{}\begin{matrix}a+b=0.02\\58.5a+103b=1.615\end{matrix}\right.\)
\(\Rightarrow a=b=0.01\)
\(\%NaCl=\dfrac{0.01\cdot58.5}{1.615}\cdot100\%=36.22\%\)
\(\%Nà=100-36.22=63.78\%\)
\(m_{\downarrow}=m_{AgCl}+m_{AgBr}=0.01\cdot143.5+0.01\cdot188=3.315\left(g\right)\)