Cho 300 ml dung dịch cuso4 1M tác dụng với 70ml dung dịch NaOH 2M. tìm C\(_M\) dung dịch các chất sau phản ứng kết thúc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{CuSO_4}=1.0,01=0,01(mol)\\ PTHH:Fe+CuSO_4\to FeSO_4+Cu\)
Do Cu ko td với HCl nên chất rắn sau phản ứng vẫn là Cu
\(n_{Cu}=n_{Fe}=0,01(mol)\\ \Rightarrow m_{Cu}=0,01.64=0,64(g)\\ b,PTHH:FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ \Rightarrow n_{NaOH}=2n_{FeSO_4}=2n_{Fe}=0,02(mol)\\ \Rightarrow V_{dd_{NaOH}}=0,02.1=0,02(l)\)

Đáp án C
Trong 100ml dd X có 0,1 mol Ba2+, 0,15 mol .
Trong 200ml dung dịch X có 0,2 mol Cl-.
Do đó trong 50 ml dung dịch X có 0,05 mol Ba2+, 0,075 mol , 0,05 mol Cl- và x mol K+
Theo định luật bảo toàn điện tích được x = 0,025
Khi cô cạn xảy ra quá trình:


Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó: n C O 3 2 - = 0 , 0375
Vậy khối lượng chất rắn khan thu được là: m K + + m B a 2 + + m C O 3 2 - + m C l - = 11 , 85 ( g a m )
Đáp án C

Đáp án C
+ Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa⇒ n BaCO3 = n Ba2+ 0,1 mol . Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa
⇒ n BaCO3- = n HCO3- = 0,15 mol
⇒ Trong 100ml ddX có 0,1 mol Ba2+ , 0,15 mol HCO3- .
+ Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa ⇒ Trong 200ml ddX có nCl- = n AgCl = 0,2 mol
⇒ Trong 50ml ddX có 0,05 mol Ba2+ ; 0,075 mol HCO3- , 0,05 mol Cl- ⇒ nK+ = 0,025
2HCO3- → CO32- + CO2 + H2O
0,075 → 0,0375 0,0375(mol)
Khi đun sôi đến cạn: mkhan = m HCO3- + m Ba2+ + m K+ + m Cl- - m CO2 – m H2O
= 0,05.137 + 0,075.61 + 0,05.35,5 + 0,025.39 – 0,0375.44 - 0,0375.18 = 11,85g

Ta có nH2SO4 = 0,2 . 1,5 = 0,3 ( mol )
nBa(OH)2 = 0,3 . 0,8 = 0,24 ( mol )
H2SO4 + Ba(OH)2 → BaSO4 + 2H2O
0,3...........0,24
⇒Lập tỉ số 0,3/1:0,24/1 = 0,3 > 0,24
⇒Sau phản ứng H2SO4 dư , Ba(OH)2 hết
⇒mBaSO4 = 0,24 . 233 = 55,92 ( gam )
⇒nH2SO4 dư = 0,3 - 0,24 = 0,06 ( mol )
⇒CM H2SO4 dư = 0,06 : 0,5 = 0,12 M

a) \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
b) \(n_{CuSO_4}=0,4.1=0,4\left(mol\right)\)
\(n_{NaOH}=\dfrac{40}{40}=1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,4}{1}< \dfrac{1}{2}\) => CuSO4 hết, NaOH dư
PTHH: CuSO4 + 2NaOH --> Cu(OH)2 + Na2SO4
_______0,4----->0,8---------->0,4-------->0,4
Cu(OH)2 --to--> CuO + H2O
0,4------------->0,4
=> mCuO = 0,4.80 = 32 (g)
c) \(\left\{{}\begin{matrix}m_{NaOH\left(dư\right)}=\left(1-0,8\right).40=8\left(g\right)\\m_{Na_2SO_4}=0,4.142=56,8\left(g\right)\end{matrix}\right.\)

Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
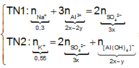
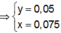
![]() thỏa mãn
thỏa mãn
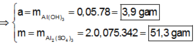
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
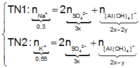
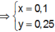
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.
\(n_{CuSO_4}=1\cdot0,3=0,3\left(mol\right);n_{NaOH}=2\cdot0,07=0,14\left(mol\right)\\ PTHH:CuSO_4+2NaOH\rightarrow Na_2SO_4+Cu\left(OH\right)_2\downarrow\\ \text{Vì }\dfrac{n_{CuSO_4}}{1}>\dfrac{n_{NaOH}}{2}\Rightarrow CuSO_4\text{ dư}\\ \Rightarrow n_{Na_2SO_4}=\dfrac{1}{2}n_{NaOH}=0,07\left(mol\right)\\ \Rightarrow C_{M_{Na_2SO_4}}=\dfrac{0,07}{0,3+0,07}\approx1,19M\)