Hai bình điện phân (CuSO4/Cu và AgNO3/Ag) mắc nối tiếp . Trong một mạch điện . Sau 1 thời gian điện phân , khối lượng của catot của 2 bình tăng lên 2,8g . Biết đồng có khối lượng mol nguyên tử là 64g/mol , hóa trị 2 và bạc có khối lượng mol nguyên tử là 108 g/mol , hóa trị 1
a) Tính điện lượng qua các bình điện phân và khối lượng Cu và Ag được giải phóng ở catot
b) Nếu I=0,5A . Tính thời gian điện phân .

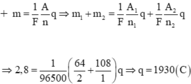
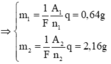


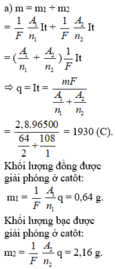

a/ \(m_{Cu}=\dfrac{I.A_{Cu}.t}{F.n_{Cu}};m_{Ag}=\dfrac{I.A_{Ag}.t}{F.n_{Ag}}\)
\(m_{Cu}+m_{Ag}=2,8\Leftrightarrow\dfrac{I.64.t}{96500.2}+\dfrac{I.108.t}{96500.1}=2,8\)
\(\Rightarrow q=I.t=2,8.\dfrac{4825}{7}=1930\left(C\right)\)
\(\Rightarrow m_{Cu}=\dfrac{1930.64}{96500.2}=...\left(g\right);m_{Ag}=\dfrac{1930.108}{96500}=...\left(g\right)\)
b/ \(q=I.t=1930\Rightarrow t=\dfrac{1930}{0,5}=3860\left(s\right)\)