Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có nZn= 0,65/65=0,1(mol)
a,PTPƯ: Zn + 2HCl ---> ZnCl2 + H2
(mol) 0,1 ---> 0,05 ---> 0,1 ---> 0,1
b, Theo pt có mmuối= 0,1.136=13.6(g)
Lại có Vkhí=0,1.22,4= 2,24(l)
c, Theo pt có mHCl= 0,05.36,5=1,825(g)
=> C%=\(\dfrac{1,825}{200}\).100%=0,9125%

(1)
$n_{H_2} = \dfrac{11,2}{22,4} = 0,5(mol)$
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,5 1 0,5 0,5 (mol)
Sau phản ứng : $m_{dd} = 0,5.24 + 100 - 0,5.2 = 111(gam)$
$C\%_{MgCl_2} = \dfrac{0,5.95}{111}.100\% = 42,79\%$
(2)
Trích mẫu thử
Cho dung dịch $H_2SO_4$ tới dư vào mẫu thử :
- mẫu thử tạo khí không màu là $Na_2CO_3$
$Na_2CO_3 + H_2SO_4 \to Na_2SO_4 + CO_2 + H_2O$
- mẫu thử tạo kết tủa trắng là $BaCl_2$
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
- mẫu thử không hiện tượng là $NaNO_3$

a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
b) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Zn}\) \(\Rightarrow n_{ZnO}=\dfrac{20-0,1\cdot65}{81}=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow n_{ZnCl_2}=n_{Zn}+n_{ZnO}=\dfrac{4}{15}\left(mol\right)\)
Mặt khác: \(m_{H_2}=0,1\cdot2=0,2\left(g\right)\)
\(\Rightarrow m_{dd}=m_{hh}+m_{ddHCl}-m_{H_2}=119,8\left(g\right)\) \(\Rightarrow C\%_{ZnCl_2}=\dfrac{\dfrac{4}{15}\cdot136}{119,8}\cdot100\%\approx30,27\%\)
c) Giả sử khí là SO2
PTHH: \(Zn+H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}ZnSO_4+SO_2\uparrow+H_2O\)
Theo PTHH: \(n_{SO_2}=n_{Zn}=0,1\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,1\cdot22,4=2,24\left(l\right)\)

Ta có: \(n_{HCl}=\dfrac{200}{1000}.2=0,4\left(mol\right)\)
\(PTHH:Mg+2HCl--->MgCl_2+H_2\uparrow\left(1\right)\)
a. Theo PT(1): \(n_{Mg}=n_{H_2}=n_{MgCl_2}=\dfrac{1}{2}.n_{HCl}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,2.24=4,8\left(g\right)\\V_{H_2}=0,2.22,4=4,48\left(lít\right)\end{matrix}\right.\)
b. \(PTHH:2NaOH+MgCl_2--->Mg\left(OH\right)_2\downarrow+2NaCl\left(2\right)\)
Ta có: \(n_{NaOH}=\dfrac{\dfrac{20\%.100}{100\%}}{40}=0,5\left(mol\right)\)
Ta thấy: \(\dfrac{0,5}{2}>\dfrac{0,2}{1}\)
Vậy NaOH dư.
Theo PT(2): \(n_{Mg\left(OH\right)_2}=n_{MgCl_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Mg\left(OH\right)_2}=0,2.58=11,6\left(g\right)\)
a: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
200ml=0,2 lít
\(n_{HCl}=0.2\cdot22.4=4.48\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=2.24\left(mol\right)\)
\(\Leftrightarrow m_{H_2}=n_{H_2}\cdot M=2.24\cdot1=2.24\left(g\right)\)
\(n_{MgCl_2}=2.24\left(mol\right)\)
\(\Leftrightarrow n_{Mg}=2.24\left(mol\right)\)
\(\Leftrightarrow m_{Mg}=2.24\cdot24=53.76\left(g\right)\)
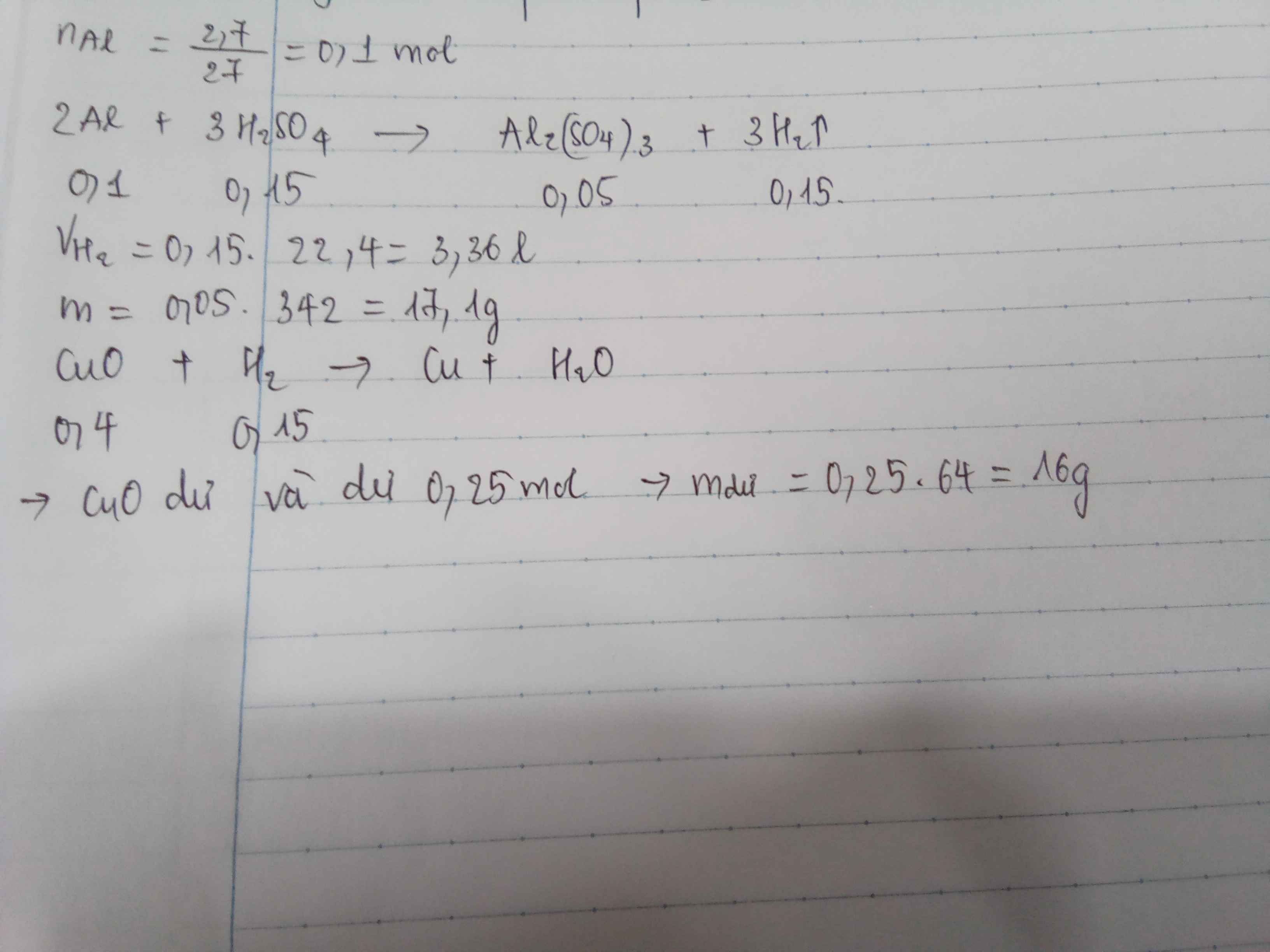
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(n_{HCl}=\dfrac{200\cdot71\%}{36,5}=\dfrac{284}{73}\left(mol\right)\)
\(\Rightarrow n_{Fe}=n_{FeCl_2}=n_{H_2}=\dfrac{142}{73}\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=\dfrac{142}{73}\cdot56\approx108,93\left(g\right)\\m_{FeCl_2}=\dfrac{142}{73}\cdot127\approx247,04\left(g\right)\\m_{H_2}=\dfrac{142}{73}\cdot2\approx3,89\left(g\right)\\V_{H_2}=\dfrac{142}{73}\cdot22,4\approx43,57\left(l\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Fe}+m_{ddHCl}-m_{H_2}=305,04\left(g\right)\)
\(\Rightarrow C\%_{FeCl_2}=\dfrac{247,04}{305,04}\cdot100\%\approx80,99\%\)
Fe + 2HCl ➝ FeCl2 + H2
mHCl = 200.71% = 142 (g) => nHCl = \(\dfrac{284}{73}\) (mol)
nFe = \(\dfrac{1}{2}\) nHCl = \(\dfrac{142}{73}\) (mol) => m ≃ 108,9 (g)
nH2 = nFe => V ≃ 43,57 (l)
nFeCl2 = nFe => C% ≃ 80%
(Mk nghĩ bạn nên kiểm tra lại đề vì số liệu không được đẹp cho lắm)