Cho một luồng CO dư đi qua ống sứ chứa 15,3 gam hỗn hợp gồm FeO và ZnO
nung nóng, thu được một hỗn hợp chất rắn có khối lượng 12, 74 gam. Biết ZnO không bị
khử bởi CO; FeO bị khử bởi CO thu được Fe và CO2
c. Tính % về khối lượng của mỗi oxit có trong hỗn hợp ban đầu?
d. Để hòa tan hoàn toàn lượng chất rắn thu được sau phản ứng trên phải dùng bao nhiêu
gam HC
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{FeO}=a\left(mol\right),n_{ZnO}=b\left(mol\right)\)
\(m_{hh}=72a+81b=15.3\left(g\right)\left(1\right)\)
\(TC:n_{FeO\left(pư\right)}=0.8a\left(mol\right),n_{ZnO\left(pư\right)}=0.8b\left(mol\right)\)
\(FeO+CO\underrightarrow{t^0}Fe+CO_2\)
\(ZnO+CO\underrightarrow{t^0}Zn+CO_2\)
\(BTKL:\)
\(15.3+28n_{CO}=12.74+44n_{CO}\)
\(\Rightarrow n_{CO}=\dfrac{15.3-12.74}{44-28}=0.16\left(mol\right)\)
\(\Rightarrow0.8a+0.8b=0.16\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(\%FeO=\dfrac{0.1\cdot72}{15.3}\cdot100\%=47.06\%\)
\(\%ZnO=52.94\%\)

A
Ta có nO = nCaCO3 = 1,5.10-3.
Vậy m = 2,15 + 16. 1,5.10-3 = 2,174 gam

n B a C O 3 = 0,046 mol
Các phản ứng có thể xảy ra khi cho CO đi qua hỗn hợp A:
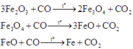
Do đó 4 chất trong hỗn hợp B gồm Fe, FeO, Fe3O4 và Fe2O3 và khí thoát ra là CO2. Khi hấp thụ CO2 vào dung dịch Ba(OH) dư:
![]()
Do đó ![]()
Từ đây, ta có một số cách để tính khối lượng của hỗn hợp ban đầu như sau:
Cách 1: Áp dụng định luật bảo toàn khối lượng
Quan sát các phương trình phản ứng, ta có
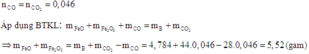
Cách 2: Tăng giảm khối lượng
Nhận thấy: Cứ mỗi phân tử CO lấy một nguyên tử O từ oxit tạo thành 1 phân tử CO2 thì khối lượng chất rắn giảm 16 gam.
Do đó để tạo thành 0,046 mol CO2 thì khối lượng chất rắn đã giảm: 16.0,046 = 0,736 (gam)
Nên m c h ấ t r ắ n b a n đ ầ u = m B + m g i ả m = 4,784 + 0,736 = 5,52 (gam)
Cách 3: Sử dụng hệ quả của định luật bảo toàn khối lượng trong phản ứng nhiệt luyện
Quan sát đặc điểm của các phương trình phản ứng cũng như kiến thức - phương pháp đã nêu ở phần trên ta có:
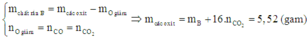
Khi đã biết tổng khối lượng hỗn hợp ban đầu và tổng số mol các chất trong hỗn hợp ban đầu, để tính được số mol cụ thể của từng chất ta tiến hành lập hệ:
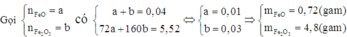
Đáp án D.

Đáp án : C
Tổng quát : CO + OOxit -> CO2
,nB = 0,5 mol ; MB = 40,8g => có CO và CO2
=> nCO = 0,1 ; nCO2 = 0,4 mol
=> mX = mA + mO pứ = 64 + 0,4.16 = 70,4g
Các phản ứng khử sắt oxit có thể có:
3Fe2O3 + CO --> 2Fe3O4 + CO2 (1)
Fe3O4 + CO --> 3FeO + CO2 (2)
FeO + CO --> Fe + CO2 (3)
Như vậy chất rắn A có thể gồm 3 chất Fe, FeO, Fe3O4 hoặc ít hơn, điều đó không quan trọng và việc cân bằng các phương trình trên cũng không cần thiết, quan trọng là số mol CO phản ứng bao giờ cũng bằng số mol CO2 tạo thành. nB = 11,2/22,5 = 0,5 mol
Gọi x là số mol của CO2 ta có phương trình về khối lượng của B:
44x + 28(0,5 x) = 0,5 x 20,4 x 2 = 20,4
nhận được x = 0,4 mol và đó cũng chính là số mol CO tham gia phản ứng.
Theo ĐLBTKL ta có:
mX + mCO = mA + mCO2
--> m = 64 + 0,4 x 44 - 0,4 x 28 = 70,4 gam
chon C nha

Các phản ứng khử sắt oxit có thể có:
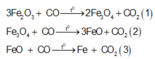
Như vậy chất rắn A có thể gồm 3 chất Fe, FeO, Fe3O4 Fe2O3 dư hoặc ít chất hơn, điều đó không quan trọng và việc cân bằng các phương trình trên cũng không cần thiết, các bạn chỉ cần quan sát và nhận thấy luôn có: n C O 2 = n C O
n B = 11 , 2 22 , 4 = 0 , 5 m o l .
Ta có B gồm CO2 mới tạo thành và CO dư
Gọi:
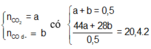

Áp dụng định luật bảo toàn khối lượng ta có:
![]()
⇒ m = 64 + 0,4.44 - 0,4.28 = 60,4 (gam)
Đáp án C.
Các phản ứng khử sắt oxit có thể có:
3Fe2O3 + CO --> 2Fe3O4 + CO2 (1)
Fe3O4 + CO --> 3FeO + CO2 (2)
FeO + CO --> Fe + CO2 (3)
Như vậy chất rắn A có thể gồm 3 chất Fe, FeO, Fe3O4 hoặc ít hơn, điều đó không quan trọng và việc cân bằng các phương trình trên cũng không cần thiết, quan trọng là số mol CO phản ứng bao giờ cũng bằng số mol CO2 tạo thành. nB = 11,2/22,5 = 0,5 mol
Gọi x là số mol của CO2 ta có phương trình về khối lượng của B:
44x + 28(0,5 x) = 0,5 x 20,4 x 2 = 20,4
nhận được x = 0,4 mol và đó cũng chính là số mol CO tham gia phản ứng.
Theo ĐLBTKL ta có:
mX + mCO = mA + mCO2
--> m = 64 + 0,4 x 44 - 0,4 x 28 = 70,4 gam.
chọn C nha

\(n_{CO\left(dư\right)}=a\left(mol\right)\)
\(n_{CO_2}=b\left(mol\right)\)
\(n_B=a+b=0.5\left(mol\right)\left(1\right)\)
\(m_B=2\cdot20.4\cdot0.5=20.4\left(g\right)\)
\(\Rightarrow28a+44b=20.4\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.4\)
\(n_{CO\left(pư\right)}=n_{CO_2}=0.4\left(mol\right)\)
\(BTKL:\)
\(m_X+m_{CO}=m_A+m_B\)
\(\Leftrightarrow m_X=64+0.4\cdot44-0.4\cdot28=70.4\left(g\right)\)
Các phản ứng khử sắt oxit có thể có:
3Fe2O3 + CO --> 2Fe3O4 + CO2 (1)
Fe3O4 + CO --> 3FeO + CO2 (2)
FeO + CO --> Fe + CO2 (3)
Như vậy chất rắn A có thể gồm 3 chất Fe, FeO, Fe3O4 hoặc ít hơn, điều đó không quan trọng và việc cân bằng các phương trình trên cũng không cần thiết, quan trọng là số mol CO phản ứng bao giờ cũng bằng số mol CO2 tạo thành. nB = 11,2/22,5 = 0,5 mol
Gọi x là số mol của CO2 ta có phương trình về khối lượng của B:
44x + 28(0,5 x) = 0,5 x 20,4 x 2 = 20,4
nhận được x = 0,4 mol và đó cũng chính là số mol CO tham gia phản ứng.
Theo ĐLBTKL ta có:
mX + mCO = mA + mCO2
--> m = 64 + 0,4 x 44 - 0,4 x 28 = 70,4 gam.

c) PTHH : FeO + CO -to--> Fe + CO2
mCR(giảm) = mO(FeO) = 15,3 - 12,74 = 2,56 (g)
=> nO(FeO) = 0,16 (mol) = nFeO
=> mFeO = 0,16.72 = 11,52 (g)
=> mZnO = 15,3 - 11,52 = 3,78 (g)
%mFeO = 11,52.100%/15,3 = 75,3%
%mZnO = 100% - 75,3% = 24,7%
d) Fe + 2HCl ----> FeCl2 + H2
ZnO + 2HCl ---> ZnCl2 + H2O
nZnO = 3,78/81=7/150 (mol)
Theo pthh : tổng nHCl = 2nFe + 2nZnO = 0,16.2 + 2.7/150 =31/75 (mol)
=> mHCl = 36,5.31/75 = 15,086 (g)