Hòa tan hoàn toàn 9,65 gam hỗn hợp 2 kim loại Fe, Al trong dung dịch hỗn hợp HCl và H2SO4 loãng, dư kết thúc thu được 7,28 lít khí H2 (đktc). Phần trăm khối lượng của nhôm trong hỗn hợp ban đầu là
A. 41,97%.
B. 56,48%.
C. 42,53%.
D. 45,32%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
n H 2 = 0 , 2 ( m o l )
=> mhh= mFe + mAl
Bảo toàn electron:
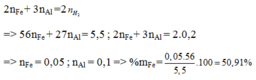

Sửa đề : 13.9 (g)
\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(\Rightarrow m=27a+56b=13.9\left(1\right)\)
\(n_{H_2}=\dfrac{7.84}{22.4}=0.35\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=1.5a+b=0.35\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.2\)
\(\%Al=\dfrac{0.1\cdot27}{13.9}\cdot100\%=19.42\%\)
\(\%Fe=100-19.42=80.58\%\)

Đặt \(n_{Fe}=x(mol);n_{Al}=y(mol)\Rightarrow 56x+27y=11(1)\)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ PTHH:Fe+H_2SO_4\to FeSO_4+H_2\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ \Rightarrow x+1,5y=0,4(2)\\ (1)(2)\Rightarrow x=0,1(mol);y=0,2(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\\ \Rightarrow \%_{Al}=100\%-50,91\%=49,09\%\)

Gọi x,y lần lượt là số mol của Al, Fe
nH2 = \(\dfrac{8,96}{22,4}\)=0,4 mol
Pt: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
......x.................................0,5x...........1,5x
.....Fe + H2SO4 --> FeSO4 + H2
.......y..........................y............y
Ta có hệ pt:
{27x+56y=11
1,5x+y=0,4
⇔x=0,2, y=0,1
% mAl = \(\dfrac{0,2.27}{11}\).100%=49,1%
% mFe = \(\dfrac{0,1.56}{11}\).100%=50,9%
mAl2(SO4)3 = 0,5x . 342 = 0,5 . 0,2 . 342 = 34,2 (g)
mFeSO4 = 152y = 152 . 0,1 = 15,2 (g)
Gọi CTTQ: MxOy
Pt: MxOy + yH2 --to--> xM + yH2O
\(\dfrac{0,4}{y}\)<-------0,4
Ta có: 232,2=\(\dfrac{0,4}{y}\)(56x+16y)
⇔23,2=\(\dfrac{22,4x}{y}\)+6,4
⇔\(\dfrac{22,4x}{y}\)=16,8
⇔22,4x=16,8y
⇔x:y=3:4
Vậy CTHH của oxit: Fe3O4
Đáp án A
Đặt nFe = a và nAl = b.
+ Phương trình theo khối lượng hỗn hợp: 56a + 27b = 9,65 (1)
+ Phương trình bảo toàn e là: 2a + 3b = 2nH2 = 0,65 (2)
+ Giải hệ (1) và (2) ⇒ nAl = b = 0,15 mol
⇒ %mAl = 0,15×27/9,65 × 100 ≈ 41,97%