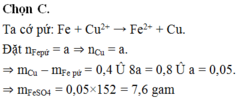Ngâm một lá Fe có khối lượng 100 gam trong 200 ml dung dịch CuSO4 0,5M một thời gian lấy lá Fe ra rửa sạch, sấy khô cân lại thấy nặng 100,4 gam. Giả sử toàn bộ kim loại sinh ra đều bám vào thanh sắt. Khối lượng FeSO4 có trong dung dịch sau phản ứng là
![]()
![]()
![]()
![]()