Khi nhỏ từ từ đến dư dung dịch NaOH vào
dung dịch AlCl3, kết quả thí nghiệm được biểu
diễn trên đồ thị sau (số liệu tính theo đơn vị mol).
Tỷ lệ x : y là :

A. 6 : 7
B. 7 : 8
C. 5 : 4
D. 4 : 5
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
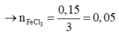
![]()
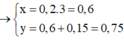
=> x:y = 4:5
CH2=CH-C≡CH + H2 → Pd , PbCO 3 H 2 , t o CH2=CH-CH=CH2
nCH2=CH-CH=CH2 + nCH2=CH-CN → xt , p t o (-CH2-CH=CH-CH2-CH2-CH(CN)-)n.

Các phương trình phản ứng: 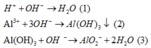
Tại 0,6 mol KOH thì chỉ xảy ra phản ứng (1):
![]()
![]()
*Cách 1: Khi kết tủa cực đại thì AlCL3 chuyển hết về Al(OH)3
![]()
Tại 2,2 mol KOH thì xảy ra cả (1), (2), (3), khi đó lượng kết tủa bị hòa tan một phần
Sơ đồ phản ứng:

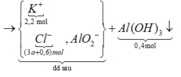
![]()
![]()
![]()
![]()
Tại thời điểm x mol KOH thì xảy ra cả (1), (2) (3), khi đó lượng kết tủa bị hòa tan hoàn toàn:
Sơ đồ phản ứng: 
![]()
![]()
![]()
![]()
![]()
*Cách 2:
· Xét 2,2 mol KOH và 0,4 mol Al(OH)3:
Xảy ra cả (1), (2), (3): kết tủa tan một phần
![]()
![]()
![]()
Khi kết tủa cực đại thì AlCl3 chuyển hết về Al(OH)3
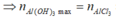
![]()
· Xét tại x mol KOH: kết tủa tan hoàn toàn:
![]()
![]()
![]()
Đáp án D.

Giải thích:
Cho từ từ đến dư NaOH vào AlCl3 ta có:
Kết tủa cực đại khi tất cả Al3+ chuyển thành Al(OH)3
Từ đồ thị: nAl(OH)3 max = 0,24 (mol) => nAl3+ ban đầu = 0,24 (mol)
+ nOH- = 0,42 mol => chỉ tạo kết tủa Al(OH)3. Khi đó nAl(OH)3 = 1/3nOH- = 1/3. 0,42 = 0,14 (mol) (1)
+ nOH- = x mol => tạo kết tủa Al(OH)3 cực đại sau đó kết tủa Al(OH)3 tan dần đến khi còn lại đúng 1 lượng như ở (1)
Al3+ + 3OH- → Al(OH)3↓
0,14← 0,42 ← 0,14
Al3+ + 4OH- → AlO2- + H2O
(0,24- 0,14)→ 0,4
∑ nOH- = 0,42 + 0,4 = 0,82 (mol)
Đáp án A
Chọn A
Tại nkết tủa = a mol => AlCl3 phản ứng vừa đủ với bazo => x = 3a => a = nAlCl3
Tại nkết tủa = 0,5a mol => kết tủa tan 1 phần : nAl(OH)3 = 4nAl3+ - nOH =>0,5a =4.a –y
=> y = 3,5a => x : y = 6 : 7