Hòa tan hoàn toàn 3,76 gam hỗn hợp Al, Mg, Fe, Zn vào 100 gam dung dịch gồm NaNO3 1M và H2SO4 2M, thu được dung dịch X chỉ chứa 16,66 gam muối trung hòa và hỗn hợp khí Y gồm NO, NO2, H2 (không còn sản phẩm khử nào khác và trong Y, khí H2 chiếm 14,29 % về số mol). Cho một lượng NaOH vào X, thu được dung dịch chỉ chứa một chất tan và kết tủa Z (không có khí thoát ra). Nung Z trong không khí đến khối lượng không đổi được 5,44 gam chất rắn. Nồng độ phần trăm của FeSO4 trong X là
A. 4,39%
B. 4,48%
C. 4,75%
D. 4,90%



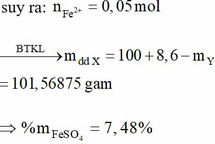
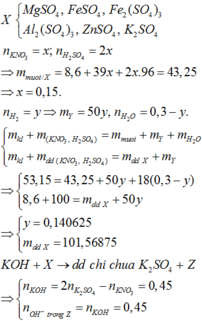
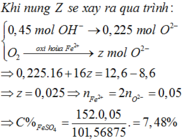


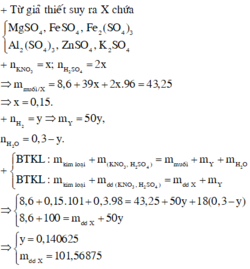

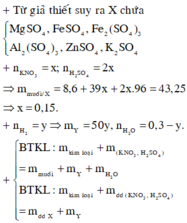


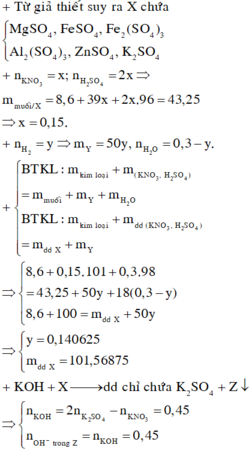




Đáp án : B
Vì có khí H2 => NO3- chuyển hết thành sản phẩm khử NO và NO2
X chỉ chứa muối trung hòa => H+ hết.
X + NaOH sau phản ứng chỉ chứa 1 chất tan => đó là Na2SO4
=> không có hiện tượng hòa tan kết tủa
=> chất rắn sau nung gồm Al2O3 ; Mg ; Fe2O3 ; ZnO
=> nO (oxit) = 0,105 mol
Bảo toàn e : 3nAl + 3nFe + 2nMg + 2nZn = 2nO = 0,21 mol (1)
Xét dung dịch X : mmuối trung hòa = mKL + m S O 4 + mNa
Gọi Vdd đầu =x
=> n N a N O 3 = x ; n H 2 S O 4 = 2x mol
=> 16,66 = 3,76 + 96.2x + 23x
=> x = 0,06 lit
=> n N a N O 3 = nNO + n N O 2 = 0,06 mol
=> n H 2 = 0,01 mol
Bảo toàn điện tích :
3nAl + 2 n F e 2 + + 3 n F e 3 + + 2nMg + 2nZn = 2 n S O 4 – nNa = 0,18 mol
Kết hợp với (1)
=> n F e S O 4 = 0,21 – 0,18 = 0,03 mol
Bảo toàn e : 3nAl + 2 n F e 2 + + 3 n F e 3 + + 2nMg + 2nZn = 3nNO + n N O 2 + 2 n H 2
=> 3nNO + n N O 2 = 0,16 mol
=> nNO = 0,05 ; n N O 2 = 0,01 mol
Bảo toàn khối lượng : mKL + mdd đầu = mdd sau + mkhí
=> mdd sau = 101,78g
=> C % F e S O 4 = 4,48%