Cho 3,36 lít khí CO2 (đktc) vào dung dịch chứa 500 ml KOH 0,1M và Ba(OH)2 0,12M kết thúc phản ứng thu được m gam kết tủa. Giá trị của m là
A. 4,925.
B. 1,970.
C. 2,550.
D. 3,940
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nCO2 = 0,15; nBa2+ = 0,06; nOH- = 0,17
Ta có nCO32- = nOH- – nCO2 = 0,17 – 0,15 = 0,02 mBaCO3 = 0,02.197 = 3,94g

Đáp án : B
nCO2 = 0,15 mol ; nOH = 0,17 mol
=> nCO3 = nOH - nCO2 = 0,02 mol < nBa = 0,06 mol
=> nBaCO3 = 0,02 mol => m = 3,94g

Đáp án C
n CO2 = 0,4 mol , n KOH = 0,12 mol , n Ba(OH)2 = 0,24 mol
=> n OH- = 0,24 .2 + 0,12 = 0,6 mol
CO2 + OH- → HCO3-
0,4 0,6 => 0,4 , n OH-dư = 0,2 mol
HCO3- + OH-→ CO32- + H2O
0,4 0,2 => 0,2 mol , dư HCO3-
Ba2+ + CO32- → BaCO3
0,24 0,2 => 0,2 mol
=> m BaCO3 = 39,4 g

Đáp án A
Theo giả thiết ta có :
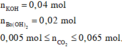
Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị :
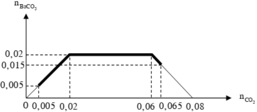
Khi 0 , 005 mol ≤ n CO 2 ⩽ 0 , 065 mol thì lượng kết tủa biến thiên theo đường nét đậm trên đồ thị. Điểm cực đại là 0,02 và cực tiểu là 0,005.
Suy ra : 0,985 gam ≤ m BaCO 3 ≤ 3,94 gam
Chọn D
Ban đầu có nCO2 = 0,15 và tổng nOH– = 0,17 → 1 < nOH–/nCO2 < 2 → Tạo cả CO32– và HCO3–
→ nCO32– = nOH– – nCO2 = 0,17 – 0,15 =0,02 < 0,06 (nBa2+) → Tạo 0,02 BaCO3
Vậy m = 0,02 x 197 = 3,94.